Tabla de contenidos
Los ácidos y las bases son dos grupos químicos relacionados entre sí. Son dos sustancias de gran importancia y presentes en la vida cotidiana.
Los ácidos y las bases son estudiados por la Química Inorgánica, rama que estudia los compuestos que no están formados por carbono.
Conceptos de ácidos y bases
El concepto de Arrhenius
Uno de los primeros conceptos de ácidos y bases desarrollado a finales del siglo XIX por Svante Arrhenius, un químico sueco.
Según Arrhenius, los ácidos son sustancias que en solución acuosa sufren ionización, liberando solo H + como cationes.
HCl (ac) → H+ (aq) + Cl– (aquí)
Mientras tanto, las bases son sustancias que sufren disociación iónica, liberando los iones OH- (hidroxilo) como único tipo de anión.
NaOH (ac) → Na+ (aq) + OH– (aquí)
Sin embargo, el concepto de Arrhenius para ácidos y bases demostró estar restringido al agua.
Lea también sobre: Teoría de Arrhenius y reacción de neutralización.
El concepto de Bronsted-Lowry
El concepto de Bronsted-Lowry es más amplio que el de Arrhenius y se introdujo en 1923.
Según esta nueva definición, los ácidos son sustancias capaces de donar un protón H+ a otras sustancias. Y las bases son sustancias capaces de aceptar un protón H+ de otras sustancias.
Eso es el el ácido es un donante de protones y la base es un receptor de protones.
Caracteriza un ácido fuerte como uno que se ioniza completamente en agua, es decir, libera iones H+.
Sin embargo, la sustancia puede ser anfiprótica, es decir, capaz de comportarse como un ácido o una base de Bronsted. Mira el ejemplo del agua (HdosO), una sustancia anfiprótica:
HNO3(aq) + HdosO(l) → NO3– (aq) + H3O+(aq) = base de Bronsted, aceptó el protón
NUEVA HAMPSHIRE3(aq) + HdosO(l) → NH4+(aq) + OH–(aq) = ácido de Bronsted, donó el protón
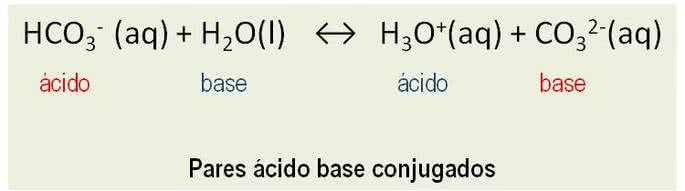
Además, las sustancias se comportan como pares conjugados. Todas las reacciones entre un ácido y una base de Bronsted implican la transferencia de un protón y tienen dos pares ácido-base conjugados. Vea el ejemplo:
HCO3– y compañía3dos-; HdosO y H3O+ son pares de bases ácidos conjugados.
Aprender más sobre:
Nomenclatura ácida
Para definir la nomenclatura, los ácidos se dividen en dos grupos:
- Hidrácidos: ácidos sin oxígeno;
- Oxiácidos: ácidos con oxígeno.
Hidrácidos
La nomenclatura ocurre de la siguiente manera:
ácido + nombre del elemento + hídrico
Ejemplos:
HCl = ácido clorhídrico
HI = ácido yodhídrico
HF = ácido fluorhídrico
oxiácidos
La nomenclatura de los oxiácidos sigue las siguientes reglas:
Tú ácidos estándar de cada familia (familias 14, 15, 16 y 17 de la Tabla Periódica) siguen la regla general:
ácido + nombre + elemento + ic
Ejemplos:
HClO3 = ácido clorhídrico
HdosSOLO4 = ácido sulfúrico
HdosCO3: ácido carbónico
Para los otros ácidos que se forman con el mismo elemento central, los nombramos en función de la cantidad de oxígeno, siguiendo la siguiente regla:
| Cantidad de oxígeno, en relación con el ácido estándar | Nomenclatura |
|---|---|
| + 1 oxígeno | Ácido + por + nombre de elemento + ico |
| – 1 oxígeno | Ácido + nombre del elemento + hueso |
| – 2 oxígenos | Ácido + hipo + nombre del elemento + hueso |
Ejemplos:
HClO4 (4 átomos de oxígeno, uno más que el ácido estándar): ácido perclórico;
HClOdos (2 átomos de oxígeno, uno menos que el ácido estándar): ácido cloroso;
HClO (1 átomo de oxígeno, dos menos que el ácido estándar): ácido hipocloroso.
También te puede interesar: ácido sulfúrico
Nomenclatura base
Para la nomenclatura base, se sigue la regla general:
Hidróxido + nombre del catión
Ejemplo:
NaOH = hidróxido de sodio
Sin embargo, cuando el mismo elemento forma cationes con diferentes cargas, el número de la carga del ion se agrega al final del nombre, en números romanos.
O puede agregar el sufijo -oso al ion menos cargado y el sufijo -ico al ion más cargado.
Ejemplo:
Hierro
Fe2+ = Fe (OH)dos = Hidróxido de hierro II o hidróxido ferroso;
Fe3+ = Fe (OH)3 = Hidróxido de hierro III o hidróxido férrico.
Asegúrese de revisar las preguntas del examen de ingreso sobre el tema, con resolución comentada, en: Ejercicios sobre funciones inorgánicas.