En 1923, Gilbert Newton Lewis poner fin a lo que llamó el «Culto a los protones», proponiendo una definición para ácidos y bases, en el mismo año en que se propuso la definición de Brönsted-Lowry. La definición de Lewis consiste en:
- Ácido son todas las especies químicas las que recibir pares electrónicos aislados, formando enlaces coordinados (antes se llamaba Dativa).
- Base son todas las especies químicas las que ceder pares aislados de electrones, formando enlaces coordinados.
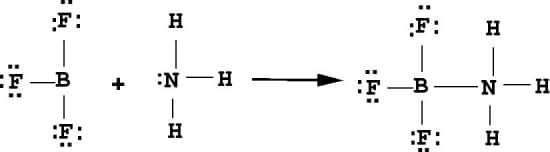
La definición de Lewis es la definición más completa de ácidos y bases, porque su definición no se limita a las especies de hidrógeno y / o hidroxilo, sino que se adapta a casi todas las reacciones químicas. Un ejemplo de esto es el BF3, al reaccionar con amoniaco y de acuerdo con el siguiente mecanismo:
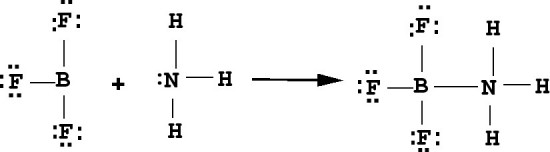
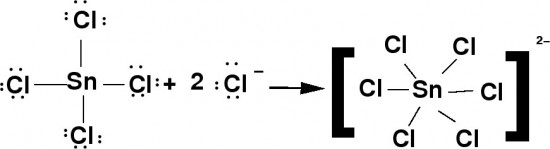
La definición de Lewis para ácidos y bases se aplica perfectamente al cloruro de estaño (IV), funciona como un ácido de Lewis fuerte debido a que tiene orbitales vacíos, recibe los pares electrónicos, suministrados por el cloro, expandiendo su valencia. Porque en realidad el átomo de estaño está rodeado, por 12 electrones en lugar de 8, formando un ion complejo con geometría octaédrica y una vez más se viola la regla del octeto.
Esta definición es muy importante, especialmente en química orgánica, ya que muchos compuestos orgánicos actúan como receptores y donantes de pares electrónicos. Muchas especies químicas pueden funcionar como ácidos y bases de Lewis. El ácido es una especie deficiente de electrones que buscan llenar sus orbitales vacíos y las bases son especies con pares de electrones sobrantes. Sin embargo, es importante señalar que la definición ácido-base de Lewis siempre tiende a formar enlaces covalentes coordinados, porque siempre existe la donación y recepción de pares electrónicos.
Bibliografía:
SALOMONES, TWG; FRYHLE, CB. Química Orgánica. Río de Janeiro: Editorial LTC. Vol. 1, 7a ed., 2001
SHRIVER, DUWARD; ATKINS, PETER. Química inorgánica – 4ª edición. Porto Alegre, Bookman, 2008.