LA afinidad electrónica o electroafinidad es una propiedad periódica (ya que corresponde al número atómico de elementos y presenta un orden de crecimiento en períodos y grupos de la tabla periódica) relacionada con la cantidad de energía liberada por un átomo cuando recibe un electrón o un anión cuando lo pierde. Se define de la siguiente manera:
Índice numérico (en energía / cantidad de materia) que representa la energía mínima gastada por una fuente externa para que un electrón sea eliminado de un anión en estado gaseoso. O la energía liberada por un átomo, gaseoso y no excitado, al recibirlo.
Entre todos los elementos de la tabla, los halógenos (elementos del grupo 7A) son los que tienen los valores absolutos más altos de afinidad electrónica, a diferencia de los metales del grupo 1A (alcalinos). Dos ejemplos son el átomo de cloro (con una afinidad electrónica en un módulo de 349 KJ / mol) y el átomo de sodio (con una afinidad electrónica en un módulo igual a 53 KJ / mol).
Prácticamente todos los elementos conocidos liberan energía cuando reciben un electrón en las condiciones especificadas. Por tanto, el valor real de la afinidad electrónica es siempre un número negativo; donde cuanto menor es este valor, mayor es la energía liberada: así, el átomo de cloro (-349 KJ / mol) libera más energía que el átomo de sodio (-53 KJ / mol).
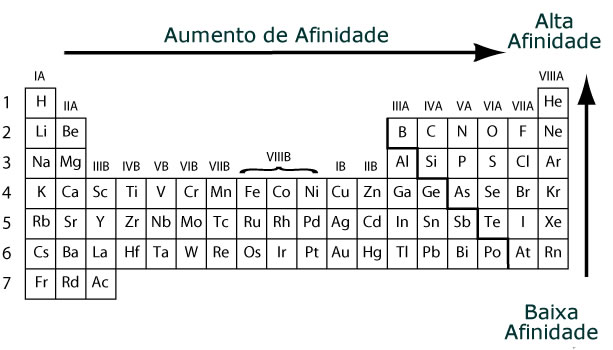
Variación de afinidad electrónica
En términos generales, la afinidad electrónica aumenta de izquierda a derecha y de abajo hacia arriba en la tabla periódica. Sin embargo, se pueden observar algunas excepciones (como el átomo de cloro que, aunque se encuentra en una posición más baja en la tabla, tiene una mayor afinidad que el átomo de flúor).
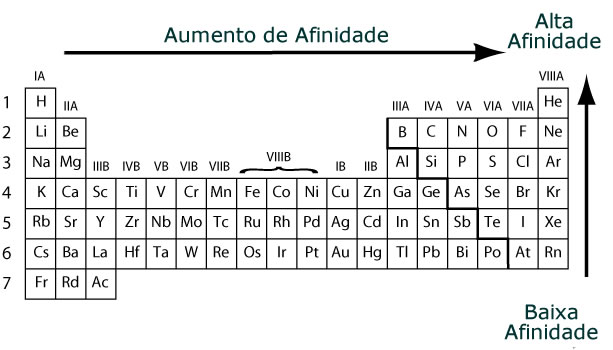
Ilustración: http://www.grandinetti.org/Teaching/Chem121/Lectures/ElectronAffinity/ (Adaptado)
Las otras propiedades periódicas también se pueden correlacionar con la afinidad electrónica:
1) electronegatividad: cuanto más electronegativo es el átomo, más afinidad electrónica tiene. Dado que el núcleo atrae electrones con más fuerza y se requiere una mayor cantidad de energía para extraerlos;
dos) rayo atómico: cuanto menor es el radio atómico, mayor es la electronegatividad, mayor se vuelve la afinidad electrónica. Por tanto, los átomos más pequeños tienen mayores afinidades que los átomos de mayor tamaño;
3) Potencial de ionización: como el potencial de ionización mide la resistencia de un átomo a convertirse en un catión monovalente (perdiendo 1 electrón), cuanto mayor es esta resistencia, más afinidad electrónica tiene el átomo. Por tanto, cuanto mayor sea el potencial de ionización, mayor será la afinidad electrónica.