Tú anticuerpos, también conocido como inmunoglobulinas (Ig) o gammaglobulinas, son glicoproteínas sintetizadas por los linfocitos B, utilizadas por el sistema inmunológico para identificar y neutralizar antígenos. Pueden presentarse de dos formas: secretadas por las células plasmáticas (B maduras), siendo solubles en el torrente sanguíneo; o unido a la membrana B, lo que confiere especificidad antigénica a la célula.
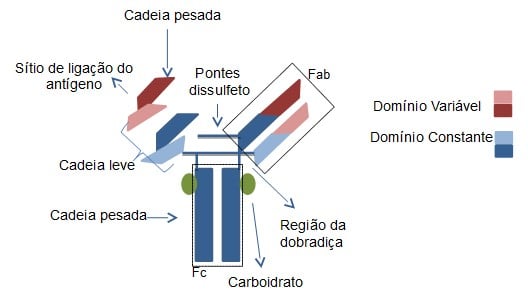
Estructuralmente, los anticuerpos están compuestos por dos cadenas ligeras idénticas y dos cadenas pesadas, también idénticas. Las cadenas ligeras están unidas a las cadenas pesadas mediante enlaces disulfuro, que varían en cantidad y posiciones entre diferentes clases de anticuerpos. Además, ambas cadenas tienen una región variable y una región constante. El dominio variable confiere especificidad al anticuerpo.
Las moléculas de anticuerpo pueden ser digeridas por enzimas. Cuando la papaína realiza la digestión, se obtienen dos fragmentos denominados Fab (fragmento de unión al antígeno) y un fragmento denominado Fc (fragmento cristalizable). Cuando la digestión se realiza con pepsina, se produce un fragmento llamado Fab2, donde los dos brazos del anticuerpo permanecen unidos y el resto se escinde en varios fragmentos más pequeños.
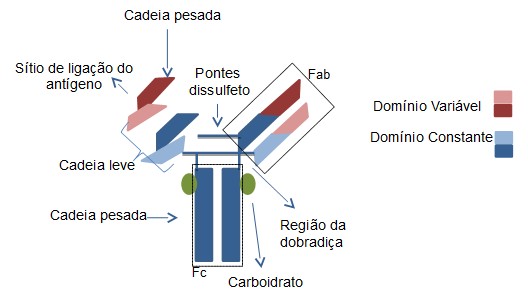
Ilustración: Isabela Canhas / .com
La interacción antígeno-anticuerpo ocurre involucrando sitios combinatorios, en los que la interacción se estabiliza mediante enlaces no covalentes, a través de los cuales se produce la complementariedad entre el epítopo antigénico y el sitio de unión del anticuerpo.
Las moléculas de anticuerpo se subdividen en clases de inmunoglobulinas definidas por los dominios constantes de sus cadenas pesadas. Las cadenas pesadas están representadas por las letras griegas μ, γ, α, δ, ε, y las inmunoglobulinas se denominan IgM, IgG, IgA, IgD e IgE, respectivamente. Las diferentes clases también se diferencian por sus propiedades biológicas, ubicaciones funcionales y diferentes mecanismos para la eliminación de antígenos del cuerpo.
La IgM es la principal inmunoglobulina de la respuesta primaria a los antígenos, siendo la primera clase que se eleva en la fase aguda de los procesos inmunológicos. Puede expresarse en la membrana de los linfocitos B durante su desarrollo, en forma monomérica y funcionando como receptor. Su forma secretada se produce antes de la maduración de los linfocitos B y, por tanto, tiene poca afinidad con los antígenos. Cuando se secretan, forman pentámeros, unidos por la cadena J (de unión), lo que confiere más eficiencia a la respuesta inmune. El mecanismo efector de IgM es la activación del sistema del complemento.
La IgG es la inmunoglobulina más abundante en la sangre y los espacios extravasculares. Es el anticuerpo más importante de la respuesta inmune secundaria. Tiene una alta afinidad por la unión específica de antígenos. Sus mecanismos efectores son la aglutinación; opsonización (recubrimiento de la superficie del antígeno que permite su reconocimiento y fagocitosis por las células del sistema inmunológico); activación de la vía clásica del sistema del complemento; neutralización de toxinas; citotoxicidad dependiente de anticuerpos mediada por células (para la lisis de la célula antigénica). Las IgG también se pueden asociar con reacciones de hipersensibilidad de tipo II y tipo III. Hay 4 subclases de IgG, todas basadas en las diferencias de sus cadenas pesadas γ (IgG1, IgG2, IgG3 e IgG4). En los seres humanos, las moléculas de IgG de todas las subclases atraviesan la barrera placentaria y confieren un alto grado de inmunidad pasiva al feto y al recién nacido.
La IgA es la principal inmunoglobulina que se encuentra en las secreciones exocrinas como saliva, lágrimas y mocos en los tractos respiratorio, genitourinario y digestivo. Confiere la inmunidad pasiva de la madre al niño, a través de la lactancia. Previenen la invasión de microorganismos y la penetración de toxinas en las células epiteliales. Se puede encontrar en forma monomérica, dimérica, trimérica o tetramérica. Hay dos subclases de IgA que son IgA1 e IgA2.
La IgD se coexpresa con IgM en la superficie de los linfocitos B maduros. La presencia de esta inmunoglobulina en la membrana de los linfocitos B indica que han migrado desde la médula ósea a los tejidos linfoides periféricos y están activos. En investigaciones recientes, se ha encontrado que las IgD están relacionadas con basófilos y mastocitos, induciéndolos a producir factores antimicrobianos para la defensa del tracto respiratorio.
La IgE es una inmunoglobulina de respuesta inmunitaria secundaria normalmente relacionada con la defensa contra gusanos y protozoos, así como fenómenos alérgicos y reacciones anafilácticas. La respuesta alérgica mediada por IgE ocurre a través de su unión a receptores en las superficies de mastocitos y basófilos.
Anticuerpos monoclonicos
Los anticuerpos monoclonales son anticuerpos producidos en un laboratorio especializado y tienen especificidad solo para un cierto epítopo del antígeno. Esta característica distingue a los anticuerpos monoclonales de los policlonales (producidos en el cuerpo), que producen varias inmunoglobulinas para responder a diferentes epítopos de la misma molécula antigénica. Debido a que son más específicos, los monoclonales generan respuestas más confiables para las pruebas de diagnóstico.
Referencias bibliográficas:
Abbas, AK, Lichtman, AH, Pillai, S. Inmunología celular y molecular. 6.ed. Río de Janeiro: Elsevier, 2008.
Chen, K; Xu, W., Wilson, M., He, B., Miller, NW, Bengtén, E., Edholm, E., Santini, PA, Rath, P., Chiu, A., Cattalini, M., Litzman, J., Bussel, J., Huang, B., Meini, A., Reisbeck, K., Cunningham-Rundles, C., Plebiani, A., Cerutti, A. La inmunoglobulina D mejora la vigilancia inmunológica activando programas antimicrobianos, proinflamatorios y estimulantes de células B en basófilos. 2009. Nature Immunology 10 (8): 889–898.
Machado, SL, Machado, RD Inmunología básica y aplicada a análisis clínicos. Disponible en:
Pereira, JMS Inmunología. Disponible en:
Teva, A., Fernández, JCC, Silva, VL Inmunología. Disponible en