Tabla de contenidos
El átomo es la unidad fundamental de la materia y la fracción más pequeña capaz de identificar un elemento químico, ya que mantiene su identidad. El término átomo se deriva del griego y significa indivisible.
Consiste en un núcleo, que contiene neutrones y protones, y electrones que rodean el núcleo.
estructura del átomo
El átomo está formado por pequeñas partículas, también llamadas partículas subatómicass: electrones, protones y neutrones.
La mayor parte de la masa del átomo se concentra en el núcleo, una región pequeña y densa. Su mayor volumen se encuentra en la electrosfera, un lugar de espacios vacíos, cuando los electrones orbitan alrededor del núcleo.
electrones
El electrón tiene una carga eléctrica negativa (-1) y casi no tiene masa, ya que su valor de 9,11 x 10-28 ge es aproximadamente 1840 veces más pequeño que la masa del núcleo. Son partículas diminutas que giran muy rápidamente alrededor del núcleo atómico.
Los electrones que se encuentran en las regiones más externas del átomo son responsables de la formación de enlaces químicos, que ocurren a través de la donación, recepción o intercambio de electrones.
protones
El protón tiene una carga eléctrica positiva (+1) del mismo valor absoluto que la carga de los electrones. De esta forma, un protón y un electrón tienden a atraerse eléctricamente.
A través de los protones es posible distinguir los elementos químicos, ya que cada átomo de un elemento tiene un número definido de protones en su núcleo, lo que se denomina número atómico.
neutrones
El neutrón no tiene carga alguna, es decir, es eléctricamente neutro. Junto con los protones, forma el núcleo atómico, que transporta toda la masa del átomo (99,9%). Tanto el protón como el neutrón tienen una masa de aproximadamente 1,67 x 10-24 gramo. Este valor representa una unidad de masa atómica de 1 μ.
El neutrón proporciona estabilidad al núcleo atómico, ya que la fuerza nuclear hace que sea atraído por electrones y protones.
Solo el átomo de hidrógeno no tiene neutrones, ya que está formado solo por un electrón que gira alrededor de un protón.
Consulte la tabla a continuación para resumen con información sobre partículas subatómicas.
| Partícula | Símbolo | Pasta
(en unidad de masa atomica) |
Cargo
(en unidad de carga eléctrica – uce) |
Localización |
|---|---|---|---|---|
| Protón | +1 | centro | ||
| Neutrón | 0 | centro | ||
| Electrón | -1 | electrosfera |
Un átomo en su estado fundamental es eléctricamente neutro, porque el número de protones es igual al número de electrones y las cargas opuestas, positivas y negativas, se cancelan entre sí.
Por ejemplo, el sodio (Na) tiene un número atómico 11, es decir, su núcleo tiene 11 protones. En consecuencia, hay 11 electrones en la electrosfera de un átomo de ese elemento.
Leer más sobre estructura atómica.
composición del átomo
Como vimos, el átomo está formado por una pequeña y densa región central llamada núcleo y a su alrededor se encuentra la electrosfera, donde se ubican los electrones, que se pueden dividir en capas electrónicas, subniveles energéticos y orbitales atómicos.
capas electrónicas
el átomo presenta niveles de energía, que corresponden a siete capas alrededor de un núcleo y en ellas se encuentran los electrones que orbitan a su alrededor. Las capas se denominan K, L, M, N, O, P y Q.

Cada capa puede contener una cierta cantidad de electrones, como se muestra en la siguiente tabla.
| Nivel de energía | capa electrónica | Número máximo de electrones |
|---|---|---|
| 1er | K | dos |
| 2do | L | 8 |
| Tercero | METRO | 18 |
| Cuarto | norte | 32 |
| Quinto | O | 32 |
| Sexto | PAG | 18 |
| Séptimo | Q | 8 |
Por ejemplo, el átomo de helio (He) tiene un número atómico 2 y por lo tanto tiene 2 protones en el núcleo. En consecuencia, en la electrosfera del átomo hay solo 2 electrones, que se encuentran en la primera y única capa electrónica del átomo, la capa K que corresponde al primer nivel de energía.
Subniveles de energía
Los niveles de energía albergan los subniveles, que están representados por s, p, d, f. Cada subnivel acomoda un número máximo de electrones, que son respectivamente 2, 6, 10 y 14.

Con esta información es posible hacer la distribución electrónica de un átomo y conocer la ubicación del electrón más externo y energético.
Ejemplo: Nitrógeno (N)
Numero atómico: 7
Distribución electrónica: 1sdos 2 sdos 2p3
El átomo de nitrógeno tiene dos niveles de energía, K y L, y sus 7 electrones ocupan los subniveles sy p.
K: sdos = 2 electrones
L: sdos + p3 = 5 electrones
Tenga en cuenta que la capa L puede contener hasta 8 electrones, pero en el átomo de nitrógeno solo hay 5 electrones en esa capa.
orbitales atómicos
Los orbitales caracterizan la región con más probabilidades de encontrar un electrón dentro de un subnivel energético (s, p, d, f) en una capa electrónica (K, L, M, N, O, P, Q).
- s subnivel: tiene 1 orbital que contiene hasta 2 electrones
- subnivel p: tiene 3 orbitales que albergan hasta 6 electrones
- Subnivel d: tiene 5 orbitales que albergan hasta 10 electrones
- Subnivel f: tiene 7 orbitales que albergan hasta 14 electrones
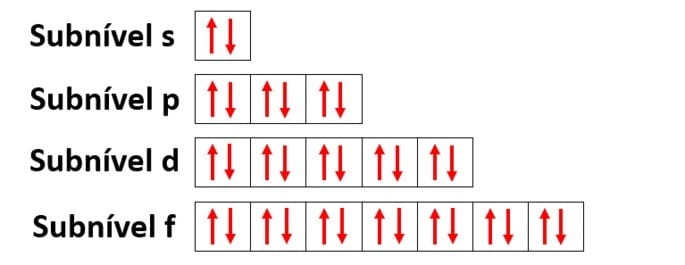
Usando nuevamente el nitrógeno como ejemplo y distribuyendo sus 7 electrones en orbitales atómicos tendríamos:

Tipos de átomos
Al observar el número de protones, neutrones y electrones podemos comparar átomos y clasificarlos en isótopos, isobaras y isotonos.
Un elemento químico se puede definir como un grupo de átomos con el mismo número de protones. Estos átomos se denominan isótopos porque tienen el mismo número atómico y masas diferentes.
Por ejemplo, en la naturaleza existen 3 isótopos del elemento hidrógeno (H): protio , deuterio
y tritio
.
Los átomos de diferentes elementos químicos se pueden clasificar como isotonos cuando tienen diferentes números atómicos y masas, pero el mismo número de neutrones.
Las isobaras son átomos de elementos diferentes, es decir, tienen un número atómico diferente, pero el mismo número de masa.
Lea más sobre isótopos, isobaras e isotonas.
Modelos atómicos (modelos atómicos)
El filósofo griego Aristóteles (384 a. C. – 322 a. C.) trató de explicar la constitución de todas las sustancias a partir de los elementos tierra, aire, fuego y agua.
Demócrito (546 a. C. – 460 a. C.), un científico y matemático griego, formuló la idea de que había un límite para la pequeñez de las partículas. Dijo que se volverían tan pequeños que ya no podrían dividirse. Llamó a esta partícula un «átomo».
Durante la mayor parte del siglo XIX, fue el modelo atómico de Dalton, un científico inglés, quien propuso la teoría atómica, que fue mucho más allá del pensamiento de los antiguos.
Esta teoría decía que todas las sustancias están formadas por pequeñas partículas indivisibles llamadas átomos, que serían como bolas de billar. A medida que avanzaban los estudios sobre la estructura de la materia, se descubrió que el átomo está formado por otras pequeñas partículas llamadas subatómicas.
Con el descubrimiento del electrón, Thomson formuló el modelo conocido como pudín de masa, que describía el átomo como una esfera positiva con electrones cargados negativamente incrustados en su superficie.
A través de experimentos el físico Rutherford descubrió que el átomo tenía vacíos y electrones alrededor de un núcleo positivo extremadamente pequeño. Así, Rutherford propuso el modelo nuclear para representar el átomo.
Bohr mejoró el modelo propuesto por Rutherford al encontrar que los electrones no giran alrededor del núcleo al azar, sino en órbitas específicas. Este modelo se conoció como planetario.