Si un cuerpo sufre solo una variación en su temperatura, sin cambiar su estado físico, decimos que el el calor es específico (o sensible). Se define como la cantidad de calor suficiente para cambiar la temperatura de una sustancia. Más precisamente, es la cantidad de calor necesaria para variar la temperatura de 1 g de sustancia en 1ºC.
Percibimos los efectos del calor específico cuando una sustancia permanece más caliente que otra, cuando ambas, con la misma temperatura inicial, se calientan por igual. Una sopa y una tostada, por ejemplo: ambos recibieron calor, pero la tostada se enfría más rápido que la sopa. Por lo tanto, el calor específico está relacionado con la capacidad del cuerpo para almacenar energía interna. El término «específico» caracteriza esta condición de que cada sustancia tenga su propia capacidad de almacenamiento, independientemente de su masa.
Entonces, suponga un cuerpo de masa m, la temperatura inicial T1, reciben una cantidad de calor sensible Q, aumentando su temperatura a Tdos (Figura 1).
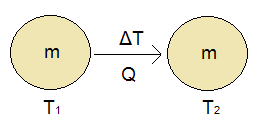
Figura 1: El cuerpo recibe calor específico Q.
Se verificó experimentalmente que la cantidad de calor Q recibido es proporcional a la masa my la variación de temperatura ΔT. Por tanto, se concluyó:
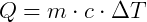
Esta ecuación se llama Ecuación fundamental de calorimetría, donde c es el coeficiente de proporcionalidad característico de la sustancia, llamado calor especifico. Se da en cal / gºC.
El calor específico del agua se llama caloría, que es la cantidad de calor necesaria para elevar la temperatura de 1 g de agua pura de 14,5ºC a 15,5ºC, a presión normal (al nivel del mar). Por la Ecuación Fundamental de Calorimetría, obtenemos:
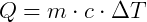
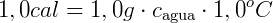
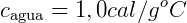
Este es el calor específico del agua. Varía en el rango de 0ºC a 100ºC, pero se aceptó constante en su valor promedio de 1.0 cal / gºC.
En la siguiente tabla tenemos los valores caloríficos específicos de algunas de las sustancias más comunes:
En la siguiente tabla tenemos los valores caloríficos específicos de algunas de las sustancias más comunes:
| Sustancia | Calor específico (cal / gºC) |
| Agua | 1.0 |
| alcohol | 0,6 |
| aluminio | 0,22 |
| aire | 0,24 |
| carbón | 0,12 |
| Plomo | 0,031 |
| cobre | 0.091 |
| planchar | 0,11 |
| hielo | 0,5 |
| latón | 0.092 |
| madera | 0,42 |
| Mercurio | 0.033 |
| oro | 0,032 |
| oxígeno | 0,22 |
| plata | 0,056 |
| vidrio | 0,16 |