Tabla de contenidos
De acuerdo con Regla del octeto, la capa de valencia necesita ocho electrones para estabilizarse.
Por tanto, los átomos adquieren estabilidad cuando tienen 8 electrones en la capa de valencia. Esto sucede con los gases nobles, tienen la capa de valencia completa. La única excepción es el elemento helio, que tiene 2 electrones.
Los otros elementos necesitan formar enlaces químicos para recibir los electrones faltantes y alcanzar los ocho electrones en la capa de valencia.
Los electrones de la capa de valencia son los que participan en los enlaces, ya que son los más externos.
Capas de electrosfera
Según el modelo atómico de Rutherford-Bohr, los electrones giran alrededor del núcleo atómico, en diferentes capas energéticas.
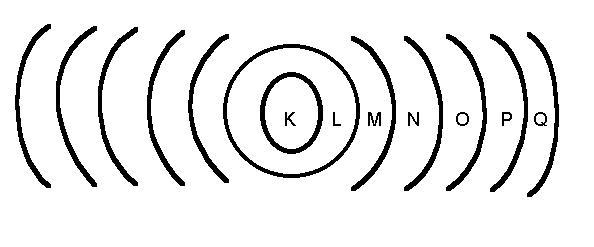
Hay siete capas designadas por las letras K, L, M, N, O, P y Q. Cada una soporta un número máximo de electrones.
[ align=»aligncenter» width=»610″]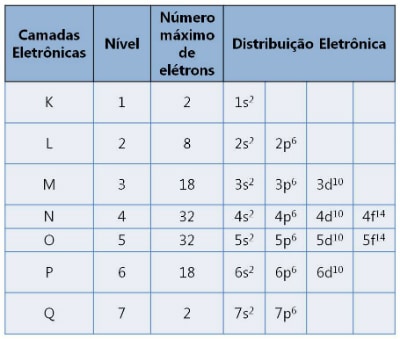
¿Cómo determinar la Capa Valencia?
La capa de valencia se puede determinar de dos formas: Distribución electrónica y Tabla periodica.
Distribución electrónica
Para determinar la capa de valencia mediante distribución electrónica, se utiliza el Diagrama de Linus Pauling.
[ align=»alignleft» width=»477″]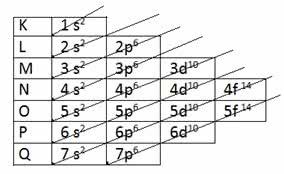
Recuerde que el diagrama de Pauling sigue el orden creciente de energía. La última capa obtenida en la distribución electrónica es la capa de valencia.
1 sdos 2 sdos 2p6 3 sdos 3p6 4sdos 3d10 4p6 5 sdos 4d10 5p6 6 sdos 4f14 5d10 6p6 7 sdos 5f14 6d10 7p6
Entonces, en la capa de valencia, el subnivel más energético es la última capa.
Ejemplos de:
Nitrógeno – N
Numero atómico: 7
Distribución electrónica: 1sdos 2 sdos 2p3
Capa Valencia: 2sdos 2p3, N tiene 5 electrones en la capa de valencia.
Hierro – Fe
Numero atómico: 26
Distribución electrónica: 1sdos 2 sdos 2p6 3 sdos 3p6 4sdos 3d6
Capa valenciana: 4sdos, Fe tiene 2 electrones en la capa de valencia.
Cloro – Cl
Numero atómico: 17
Distribución electrónica: 1sdos 2 sdos 2p6 3 sdos 3p5
Capa Valencia: 3sdos 3p5, Cl tiene 7 electrones en la capa de valencia.
Oxígeno – O
Numero atómico: 8
Distribución electrónica: 1sdos 2 sdos 2p4
Capa valenciana: 2sdos 2p4, el oxígeno tiene 6 electrones en la capa de valencia.
Carbono – C
Numero atómico: 6
Distribución electrónica: 1sdos 2 sdos 2pdos
Capa Valencia: 2sdos 2pdos, el carbono tiene 4 electrones en la capa de valencia.
Lea también sobre los números cuánticos.
Hasta ahora, los ejemplos utilizados han sido con elementos de estado fundamental. Pero el mismo principio se puede utilizar para iones, cationes y aniones. Vea el ejemplo:
Cloruro de aniones – Cl–
El número atómico del cloro es 17. Si estuviera en su estado fundamental, el número de electrones sería igual al de protones. Sin embargo, en este caso hay una ganancia de 1 electrón.
Primero, realice la distribución electrónica del elemento Cloro:
1 sdos 2 sdos 2p6 3 sdos 3p5
Con la ganancia de un electrón extra, agregue la última capa:
1 sdos 2 sdos 2p6 3 sdos 3p6. Entonces hay 8 electrones en la capa de valencia (3sdos 3p6).
Ver también: Ejercicios sobre distribución electrónica.
Tabla periodica
Para determinar la capa de valencia usando la tabla periódica, es necesario identificar el período y la familia del elemento.
Así, mientras que la familia 1A tiene 1 electrón de valencia, 2A tiene 2, y así sucesivamente. Los elementos químicos de la misma familia de la tabla periódica tienen el mismo número de electrones en la capa de valencia.
Sin embargo, esto solo es válido para los grupos 1, 2, 13, 14, 15, 16 y 17 que tienen los siguientes números de electrones en la capa de valencia 1, 2, 3, 4, 5, 6 y 7, respectivamente.
Para los elementos en los que esta relación no es posible, se debe utilizar la distribución electrónica.
¡No olvide! Los enlaces químicos surgen de la necesidad de estabilizar los átomos y así formar moléculas. Esto se hace donando electrones de la capa de valencia que, debido a que están más lejos del núcleo, tienden a donar.



