Tabla de contenidos
Las propiedades coligativas implican estudios sobre propiedades físicas de las soluciones, más precisamente un disolvente en presencia de un soluto.
Aunque no lo conocemos, las propiedades coligativas son muy utilizadas en procesos industriales e incluso en diversas situaciones cotidianas.
Relacionadas con estas propiedades están las constantes físicas, por ejemplo, la temperatura de ebullición o fusión de determinadas sustancias.
Como ejemplo, podemos mencionar el proceso de la industria del automóvil, como la adición de aditivos en los radiadores de los automóviles. Esto explica por qué en lugares más fríos, el agua del radiador no se congela.
Los procesos que se realizan con los alimentos, como el salazón de carnes o incluso los alimentos saturados de azúcar, evitan el deterioro y proliferación de organismos.
Además, la desalación del agua (remoción de sal) así como el esparcimiento de sal en la nieve en lugares donde el invierno es muy severo, corroboran la importancia de conocer los efectos coligativos en las soluciones.
¿Quieres saber más sobre los conceptos relacionados con las propiedades colectivas? Lea los artículos:
Disolvente y soluto
En primer lugar, debemos prestar atención a los conceptos de solvente y soluto, ambos componentes de una solución:
- Solvente: sustancia que se disuelve.
- Sustancia disoluta: sustancia disuelta.
Como ejemplo, podemos pensar en una solución de agua con sal, donde el agua representa el solvente y la sal, el soluto.
¿Quiere saber más? Lea también Solubilidad.
Efectos coligativos: tipos de propiedades coligativas
Los efectos coligativos están asociados a los fenómenos que ocurren con los solutos y disolventes de una solución, clasificándose en:
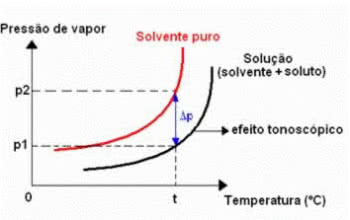
Efecto tonométrico
La tonoscopia, también llamada tonometría, es un fenómeno que se observa cuando Disminución de la presión máxima de vapor de un líquido. (solvente).
Gráfico del efecto tonométrico
Esto ocurre al disolver un soluto no volátil. Por tanto, el soluto disminuye la capacidad de evaporación del disolvente.
Este tipo de efecto coligativo se puede calcular mediante la siguiente expresión:
ΔPAG = p0 – PAG
Dónde,
ΔPAG: descenso absoluto de la presión máxima de vapor a la solución
PAG0: presión de vapor máxima del líquido puro, a la temperatura t
PAG: presión de vapor máxima de la solución, a la temperatura t
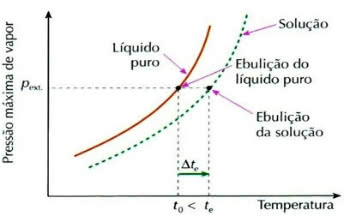
Efecto de ebullición
La ebulioscopia, también llamada ebuliometría, es un fenómeno que contribuye a la aumento de la variación de temperatura de un líquido durante el proceso de ebullición.
Gráfico del efecto ebuliométrico
Esto ocurre mediante la disolución de un soluto no volátil, por ejemplo, cuando agregamos azúcar al agua que está a punto de hervir, la temperatura de ebullición del líquido aumenta.
El llamado efecto de ebullición (o efecto de ebullición) se calcula mediante la siguiente expresión:
Δty = ty – t0
Dónde,
Δty: elevación de la temperatura de ebullición de la solución
ty: temperatura inicial de ebullición de la solución
t0: temperatura de ebullición del líquido puro
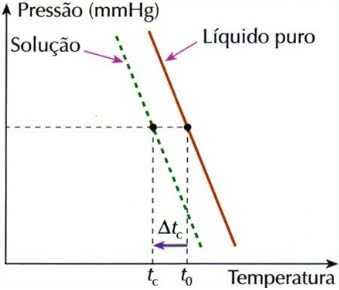
Efecto criométrico
La crioscopia, también llamada criometría, es un proceso en el que disminución de la temperatura de congelación de una solución.
Gráfico del efecto criométrico
Esto se debe a que cuando un soluto no volátil se disuelve en un líquido, la temperatura de congelación del líquido disminuye.
Un ejemplo de crioscopia son los aditivos anticongelantes que se colocan en los radiadores de los coches en lugares donde la temperatura es muy baja. Este proceso evita que el agua se congele, ayudando en la vida útil de los motores de los automóviles.
Además, la sal que se esparce por las calles de los lugares donde el invierno es muy severo, evita la acumulación de hielo en las carreteras.
Para calcular este efecto coligativo se utiliza la siguiente fórmula:
ΔtC = t0 – tC
Dónde,
ΔtC: bajar la temperatura de congelación de la solución
t0: temperatura de congelación del disolvente puro
tC: temperatura de congelación inicial del disolvente en la solución
Vea un experimento en esta propiedad en: Experimentos de química
Ley de Raoult
La llamada “Ley de Raoult” fue propuesta por el químico francés François-Marie Raoult (1830-1901).
Estudió los efectos coligativos (tonométricos, de ebullición y criométricos), ayudando en el estudio de las masas moleculares de sustancias químicas.
Al estudiar los fenómenos asociados con la fusión y ebullición del agua, llegó a la conclusión de que: al disolver 1 mol de cualquier soluto no volátil y no iónico en 1 kg de solvente, siempre se tiene la misma tonometría, ebullición o criometría. efecto.
Por tanto, la Ley de Raoult se puede expresar de la siguiente manera:
«En una solución de soluto no volátil y no iónico, el efecto coligativo es proporcional a la molalidad de la solución.”.
Puede expresarse de la siguiente manera:
PAGsolución = xsolvente . PAGdisolvente puro
Lea también sobre el número de mol y la masa molar.
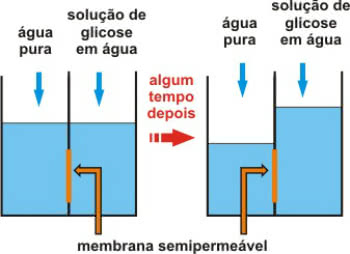
Osmometría
La osmometría es un tipo de propiedad colectiva que se relaciona con la presión osmótica de soluciones.
Recuerde que la ósmosis es un proceso físico-químico que implica el paso de agua de un medio menos concentrado (hipotónico) a otro medio más concentrado (hipertónico).
Esto ocurre a través de una membrana semipermeable, que solo permite el paso del agua.
Acción de la membrana semipermeable después de un tiempo
La llamada presión osmótica es la presión que permite que el agua se mueva. Es decir, es la presión que se ejerce sobre la solución, la que impide su dilución por el paso del disolvente puro a través de la membrana semipermeable.
Por tanto, la osmometría es el estudio y medida de la presión osmótica en soluciones.
Tenga en cuenta que en la técnica de desalinización de agua (eliminación de sal) se utiliza el proceso llamado ósmosis inversa.
Leer más sobre la ósmosis.
Leyes de osmometría
El físico y químico holandés Jacobus Henricus Van’t Hoff (1852-1911) fue el responsable de postular dos leyes asociadas con la osmometría.
La primera ley se puede expresar de la siguiente manera:
«A temperatura constante, la presión osmótica es directamente proporcional a la molaridad de la solución.«
En la segunda ley postulada por él, tenemos el siguiente enunciado:
«A molaridad constante, la presión osmótica es directamente proporcional a la temperatura absoluta de la solución.«
Por lo tanto, para calcular la presión osmótica de soluciones moleculares y diluidas, se utiliza la fórmula:
π = MRT
ser,
π: presión osmótica de la solución (atm)
METRO: molaridad de la solución (mol / L)
R: constante universal de gases perfectos = 0.082 atm. L / mol.K
T: temperatura absoluta de la solución (K)
Lea también Molaridad.
Ejercicios vestibulares con retroalimentación
1. Comparando dos cacerolas, simultáneamente en dos quemadores iguales en la misma estufa, se observa que la presión de los gases sobre el agua hirviendo en la olla a presión cerrada es mayor que sobre el agua hirviendo en una cacerola abierta.
En esta situación, y si contienen exactamente las mismas cantidades de todos los ingredientes, podemos decir que, comparado con lo que ocurre en la sartén abierta, el tiempo de cocción en la olla a presión cerrada será:
a) más baja, ya que la temperatura de ebullición será más baja.
b) menor, ya que la temperatura de ebullición será mayor.
c) menor, ya que la temperatura de ebullición no varía con la presión.
d) igual, ya que la temperatura de ebullición no depende de la presión.
e) mayor, porque la presión será mayor.
dos. (UFRN) En lugares de invierno severo, se acostumbra agregar una cierta cantidad de etilenglicol al agua de los radiadores de los automóviles. El uso de una solución, en lugar de agua, como refrigerante, se debe al hecho de que la solución tiene:
a) menor calor de fusión.
b) punto de congelación más bajo.
c) punto de congelación más alto.
d) mayor calor de fusión.
3. (Vunesp) Una de las formas de curar las heridas, según la creencia popular, es colocarles azúcar o café en polvo. La propiedad coligativa que mejor explica la extracción de líquido, por el procedimiento descrito, favoreciendo la cicatrización, es estudiada por:
a) osmometría.
b) crioscopia.
c) endoscopia.
d) tonoscopia.
e) ebullición.
4. (UFMG) En un congelador, hay cinco formas que contienen diferentes líquidos, para hacer paletas de hielo y limón. Si los moldes se colocan al mismo tiempo en el congelador y están inicialmente a la misma temperatura, el molde contiene 500 ml de:
a) agua pura.
b) solución, en agua, que contiene 50 ml de zumo de limón.
c) solución, en agua, que contiene 100 ml de zumo de limón.
d) solución, en agua, que contiene 50 ml de zumo de limón y 50 g de azúcar.
e) solución, en agua, que contiene 100 ml de zumo de limón y 50 g de azúcar.
5. (Cesgranrio-RJ) Se determinó el punto de fusión de una sustancia x, encontrándose un valor inferior al de la tabla para esa sustancia. Esto puede significar que:
a) la cantidad de sustancia utilizada en la determinación fue menor de la necesaria.
b) la cantidad de sustancia utilizada en la determinación fue mayor de lo necesario.
c) una parte de la sustancia no se ha derretido.
d) la sustancia contiene impurezas.
e) la sustancia es 100% pura.