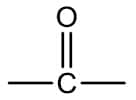
A cetonas (función cetona) son compuestos que tienen un grupo carbonilo (C = O) en el medio de la cadena, es decir, en un carbono secundario. Se forman por oxidación de alcoholes secundarios, donde se elimina un átomo de hidrógeno (unido al oxígeno) y el átomo de oxígeno comienza a formar un doble enlace con el carbono de la cadena. Las cadenas de esta clase de compuestos pueden ser abiertas o cerradas (aromáticas o no).
Las cadenas pequeñas (hasta diez átomos y carbono) dan lugar a cetonas líquidas, menos densas que el agua, de olor agradable y, en general, parcialmente solubles, a excepción de la propanona, que es completamente soluble. Las cadenas con más de diez carbonos producen cetonas sólidas insolubles en agua.
Industrialmente, muchos de los aceites esenciales extraídos de flores y frutas y utilizados en la producción de perfumes son compuestos cetónicos. También se utilizan para extraer grasa de semillas como girasoles y cacahuetes. Las cetonas también se pueden utilizar para extraer cocaína de las hojas de coca, lo que hace que su uso esté restringido y supervisado por las agencias de la policía federal.
Las cetonas con al menos un hidrógeno α (hidrógeno unido al carbono vecino al grupo carbonilo) están en equilibrio dinámico con un isómero llamado enol. Este equilibrio se conoce como tautomeria cetoenólica.
Grupo funcional
Nomenclatura de cetonas
Prefijo + tipo de conexión + ONA
| Propanona o acetona |
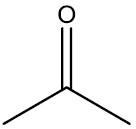 |
| 3-metil-pentan-2-ona |
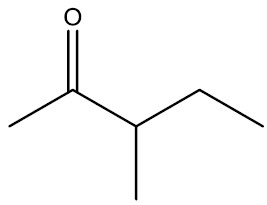 |
Cuando hay presencia de más de un grupo carbonilo en la estructura, los prefijos di, tri, tetra se pueden usar en la nomenclatura:
| Hexano-2,4-diona |
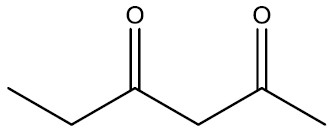 |
Existe una nomenclatura común en la que el grupo carbonilo se llama cetona y sus ligandos se consideran radicales.
| dietilcetona |
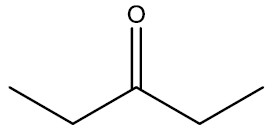 |
| Etil propil cetona |
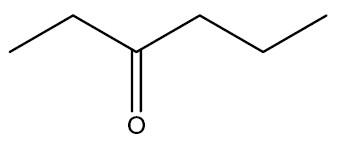 |
Las cetonas se pueden obtener en el laboratorio mediante ozonólisis de alquenos, hidratación de alquinos, el método Piria, síntesis de Friedel-Crafts y más comúnmente, a través de la oxidación de alcoholes secundarios.
En general, las cetonas son más estables que sus enoles precursores y es posible obtener el 100% del producto cetónico cuando los alquinos experimentan hidratación catalizada por ácido. El método estándar de hidratación de alquinos utiliza ácido sulfúrico acuoso como medio de reacción y utiliza sulfato de mercurio (II) u óxido de mercurio (II) como catalizador.
Algunas cetonas importantes
Acetona (propanona): es un líquido inflamable, incoloro, de olor agradable y soluble en agua. La cetona más simple se utiliza como disolvente (en lacas, resinas, acetileno), en la extracción de aceites vegetales y en la fabricación de medicamentos hipnóticos como el sulfonal (una pastilla para dormir).
Acetofenona: es la cetona aromática más simple, incolora y de alta viscosidad. Se utiliza como precursor en la preparación de diversas resinas y fragancias (principalmente como sabor artificial de almendra, cereza, jazmín y fresa) y también es el precursor académico clásico del estireno.
Lea también:
Bibliografía:
Atkins, PW, Jones, L., Principles of Chemistry: Cuestionando la vida moderna y el medio ambiente 5a ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química General, 12a ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/mateiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf