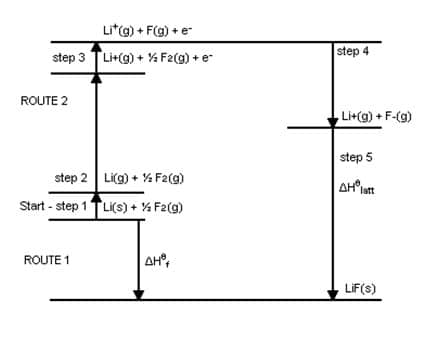
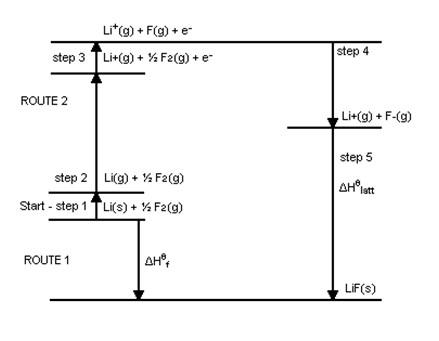
O Ciclo de Born-Haber se considera una de las aplicaciones de la Ley de Hess (para determinar la variación de entalpía de una reacción), donde a través de ella es posible medir indirectamente (utilizando otras variables) la entalpía reticular de un compuesto iónico.
La entalpía reticular se puede definir como la energía liberada por los iones en estado gaseoso cuando se combinan y forman un producto en el estado sólido, o como la energía requerida para que un compuesto iónico se descomponga en iones gaseosos. Un buen ejemplo es la determinación de esta entalpía para el compuesto LiF (fluoruro de litio):
La energía reticular asociada con LiF(s) se puede expresar a través de la ecuación:
- LiF(s) → Li+(gramo) + F–(gramo)ΔHF = ULiF
Del mismo modo, la entalpía de formación de LiF(s) de litio sólido y flúor gaseoso viene dado por la ecuación:
- Li(s) + ½F2 (g) → LiF(s)ΔHF = -594,1 KJ
Analizando la transformación de litio y flúor en iones gaseosos se obtienen los siguientes valores de variación entálpica:
1) Para el litio, existen los procesos de sublimación (transición al estado gaseoso) e ionización (pérdida de un electrón):
- Li(s) → Li(gramo)ΔHs = 155,2 KJ
- Li(gramo) → Li+(gramo) + 1e–ΔHI1 = 520,0 KJ
2) Para el fluoruro, existen los procesos de disociación (separación de la molécula al romper el enlace) y también de ionización (pero con ganancia de electrones):
- ½F2 (g) → F(gramo)ΔHD = ½ ΔH0D = 150,6 / 2 = 75,3 KJ
- F(gramo) + 1e– → F–(gramo)ΔHAF1 = -328,0 KJ
Después de estos pasos, la reacción entre los iones se expresa mediante:
- Li+(gramo) + F–(gramo) → LiF(s)ΔHF = – ULiF
Usando la ley de Hess, la suma de las variaciones de entalpía de cada paso intermedio da como resultado la variación de entalpía de la reacción final como si ocurriera en una sola vía, por lo tanto, la entalpía de formación del LiF(s) es igual a la suma de la entalpía de sublimación e ionización del litio sólido, de la disociación e ionización (medida por la afinidad electrónica, ya que recibe un electrón) del flúor más la energía reticular asociada al compuesto. O sea:
- ΔHF = ΔHs + ΔHI1 + ΔHD + ΔHAF1 – ULiF
- -594,1 = 155,2 + 520 + 75,3 – 328 – ULiF
- -594,1 = 422,5 – ULiF
- ULiF = 1.016,6 KJ
Por tanto, la entalpía reticular del fluoruro de litio es igual a 1.016,6 KJ / mol, por lo que, para que podamos transformar este compuesto en iones en estado gaseoso, debemos aportar al menos tal cantidad de energía (en proporción a la cantidad de importar).
El siguiente diagrama representa de manera similar todo el proceso de determinación ULiFseguido:
http://www.aridesa.com.br/servicos/click_professor/alexandre_lima/Ciclo_de_Born_Haber.pps (ver el 08/01/2011)