LA combustión Consiste en la reacción química entre dos o más reactivos (combustibles y oxidante) con gran liberación de energía en forma de calor. Por lo tanto, todas las reacciones de combustión son extremadamente exotérmicas (incluso si requieren que ocurra una fuente de ignición).
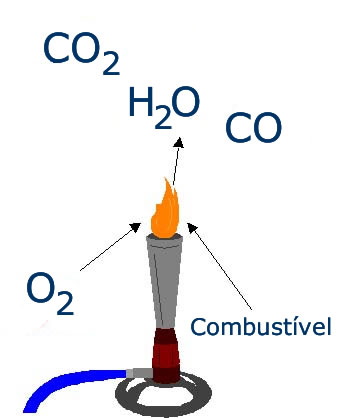 Prácticamente todos los combustibles utilizados son orgánicos (con cadenas de carbono unidas a átomos de hidrógeno u oxígeno). Algunos ejemplos son: gasolina, alcohol etílico, acetileno y metano.
Prácticamente todos los combustibles utilizados son orgánicos (con cadenas de carbono unidas a átomos de hidrógeno u oxígeno). Algunos ejemplos son: gasolina, alcohol etílico, acetileno y metano.
De la clase oxidante, el oxígeno es el más presente (aunque se pueden utilizar otras sustancias, como el flúor) y su función es oxidar el combustible añadido. En otras palabras, la combustión es, en la mayoría de los casos, una reacción de oxidación-reducción. Donde el oxígeno es el agente oxidante y casi siempre se reduce a Nox -2.
Combustión parcial y completa
En la industria, las reacciones de combustión ocurren todo el tiempo y tienen diferentes propósitos: desde la generación de vapor para mover turbinas y equipos, hasta el suministro de energía para iniciar nuevas reacciones. Y, como la oxidación completa de los combustibles libera más energía que la parcial, se vuelve más deseable.
La diferencia entre los productos de las dos oxidaciones (completa y parcial) está en la presencia de oxígeno en las moléculas: los productos de la combustión completa están saturados con átomos de oxígeno, a diferencia de los productos de la combustión parcial que tienen la capacidad de absorber más oxígeno si Se promueve una nueva combustión.
Ejemplo: Se añadieron 20 moles de metano a un reactor de combustión con suficiente oxígeno. Luego, una fuente de ignición inició la reacción que tiene una eficiencia del 85% en la producción de dióxido de carbono. Se pide calcular el porcentaje molar de los gases de escape del reactor.
Resolución:
Considere las reacciones respectivas de oxidación completa y parcial del metano:
CH4 + 2Odos -> COdos + 2HdosO (85%)
CH4 + 1,5Odos -> CO + 2HdosO (15%)
Como la oxidación del metano ocurre con una eficiencia del 85%, 17 moles se oxidarán completamente y 3 moles se oxidarán parcialmente. Así, según la estequiometría de la reacción, se formarán 17 moles de COdos, 3 mol de CO y 40 mol de HdosO (de las dos oxidaciones).
La suma final del número de moles de los gases es: 17 + 3 + 40 = 60 mol, donde:
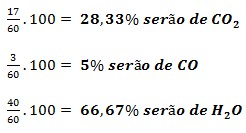
Lea también:
Ejercicios y preguntas vestibulares
Pregunta 01: (Enem 2012)
Aumentar la eficiencia de combustión de los motores de combustión y reducir sus emisiones contaminantes es el objetivo de cualquier fabricante de motores. También es el foco de la investigación brasileña que involucra experimentos con plasma, el cuarto estado de la materia y que está presente en el proceso de ignición. La interacción de la chispa emitida por la bujía con las moléculas de combustible genera el plasma que provoca la explosión liberadora de energía que, a su vez, hace que el motor funcione.
Disponible en: www.inovacaotecnologica.com.br. Consultado en: 22 jul. 2010 (adaptado).
Sin embargo, la búsqueda de la eficiencia a la que se refiere el texto tiene el siguiente factor limitante: