O jabón su uso ha sido documentado por varios pueblos antiguos, pero uno de los relatos más famosos está vinculado a la sociedad romana. Según una leyenda en Monte Sapo, que era un lugar utilizado para sacrificios de animales en forma de cremación, cuando llovía el agua llevaba las cenizas mezcladas con la grasa corporal del animal a las orillas del río Tíber y al lavar la ropa en este lugar. , las mujeres se dieron cuenta de que se limpiaban más fácilmente. Esto se debió al proceso de saponificación natural que tuvo lugar al mezclar una base (gris) con la grasa. Según la misma leyenda el nombre «jabón» proviene del nombre de Monte Sapo.
Un jabón no es más que una molécula originada a partir de un proceso de saponificación compuesto por una parte polar y una no polar. La limpieza que proporciona el jabón se debe a la capacidad de la parte polar para interactuar con el agua y la parte no polar para interactuar con la grasa. La parte polar se llama hidrofílica y la parte no polar se llama hidrofóbica. Cuando lavamos un plato, por ejemplo, estas cadenas interactúan y forman una gota de grasa llamada micela que está rodeada de agua y cargada, provocando que la grasa se desprenda de la superficie a limpiar.
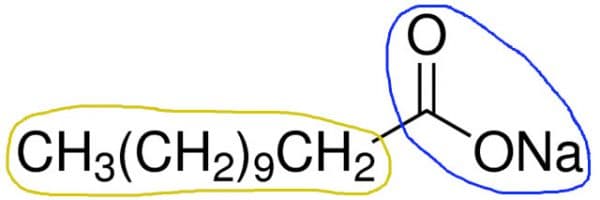
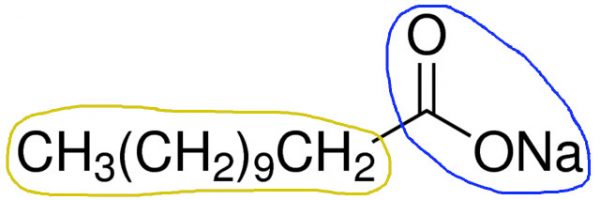
Ejemplo de una molécula de jabón:
La parte encerrada en un círculo en azul representa la parte polar de la molécula de laurato de sodio y la parte de la molécula en amarillo es la parte no polar. Ya en la figura siguiente. Podemos ver la estructura de una micela que se forma a partir de un proceso llamado emulsificación. La parte grasa o no polar / hidrofóbica está en el centro rodeada de agua o parte polar / hidrofílica.
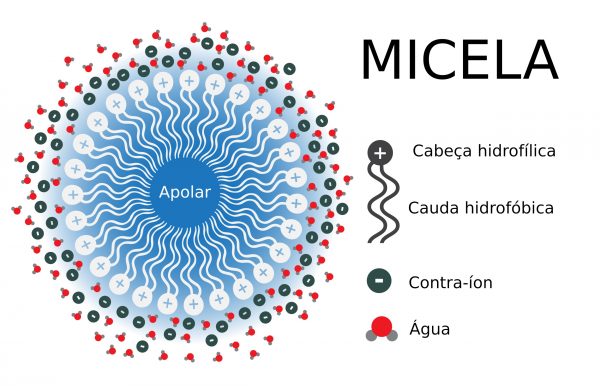
Una micela. Ilustración: DariaRen / Shutterstock.com
Hoy en día existen varios tipos de detergentes sintéticos que tienen la misma acción que los jabones, pero se diferencian en la estructura molecular, siendo la mayoría más eficientes. Lo que permanece igual es la presencia de una parte polar y una parte no polar.
Podemos ver que los jabones y detergentes han evolucionado y siguen evolucionando según el desarrollo de la Química y aportan cada vez más practicidad y eficiencia a un proceso que se utiliza tanto en el día a día en el hogar como a escala industrial.