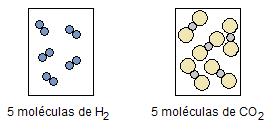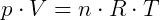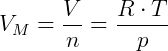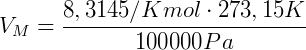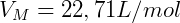En 1811, el químico italiano Avogadro (1776-1856) realizó varios estudios con gases, concluyendo lo que hoy conocemos como Hipótesis o ley de Avogadro:
«Los mismos volúmenes, de diferentes gases, cuando se miden a la misma temperatura y presión, tienen el mismo número de moléculas».
La Figura 1 muestra este hecho para el agua y el dióxido de carbono, que con igual volumen, temperatura y presión, ambos tienen el mismo número de moléculas:
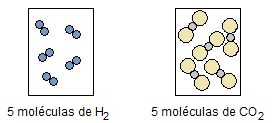
Figura 1. Volúmenes iguales, de diferentes gases, con la misma temperatura y presión.
Cuando el cuerpo está en estado gaseoso, las moléculas tienden a distanciarse unas de otras, en constante movimiento, lo que hace que las dimensiones de cada molécula sean insignificantes en comparación con las grandes distancias entre ellas. Así, el tipo de gas no influye en el volumen, que dependerá únicamente del número de moléculas y de las condiciones de temperatura y presión.
Estas condiciones de temperatura y presión se denominaron CNTP (Condiciones normales de temperatura y presión). Hasta 1982, los valores estándar de temperatura y presión eran:
T = 0ºC o 273,15 K
p = 1 atm o 101325 Pa
Pero a partir de esta fecha, IUPAC (Unión Internacional de Química Pura y Aplicada) cambió el valor de presión, de modo que los valores predeterminados ahora son los siguientes:
T = 0ºC o 273,15 K
p = 100000 Pa o 1 bar
La razón del cambio en el valor de presión se debe principalmente a algunos determinantes, como la simplificación de los cálculos, debido al redondeo a 105, compatibilidad con unidades SI (Sistema Internacional de Unidades) y los consiguientes cambios en las tablas de datos termodinámicos, que no serían grandes. Una segunda motivación sería la dificultad de alcanzar el valor exacto de 1 atm, al nivel del mar. Cuando se trata de mediciones a nivel del mar, es necesario tener en cuenta los diferentes niveles que existen en la superficie terrestre, además de las condiciones meteorológicas de la región.
Con estos cambios, la volumen molar VMETRO pasó de 22,4 L / mol a 22,71 L / mol.
El volumen molar de un gas se define como el volumen ocupado por 1 mol de ese gas, a una determinada temperatura y presión. Un lunar siempre tengo 6.02. 1023 moléculas. Considerando la temperatura y la presión en el CNTP, calcularemos el Volumen Molar con el valor de presión actual.
Para el Ecuación de Clapeyron,
Tomando R = 8.3145J / (Kmol), T = 273.15 K yp = 100000 Pa, obtenemos
Este valor es el volumen que ocupa un mol de gas, en el CNTP, independientemente de su naturaleza (tipo de gas).
Referencias bibliográficas:
FELTRE, Ricardo. Fundamentos de la química, volumen único – 1ª ed. – Moderno, 1990.
SILVA, Roberto Ribeiro da. Presión, temperatura y volumen molar, 1995. Nueva química en la escuela.