«La química moderna lo explica así: hay una combinación de sustancias y no una descomposición. Sin embargo, este punto fue ignorado por la ciencia antes del siglo XVII, que puso mayor énfasis en los aspectos cualitativos, ignorando las cantidades.«1. La Ley de Conservación de la Masa entre Reactivos y Productos fue propuesta alrededor de 1775 por Antoine Laurent Lavoisier y se afirma popularmente de la siguiente manera: en la naturaleza nada se pierde y nada se crea, todo se transforma.
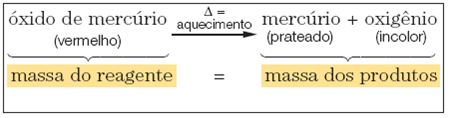
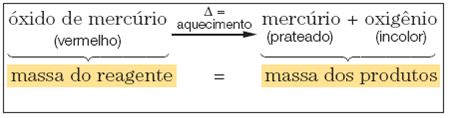
Lavoisier formuló esta ley después de realizar un experimento con óxido de mercurio (un reactivo), al que, antes de ser sometido a calentamiento, se le determinó su masa.
Cuando se coloca en un sistema cerrado; calentando este reactivo, Lavoisier obtuvo mercurio y oxígeno (productos), que, al final de la reacción, también tenían sus masas cuantificadas.
Lavoisier «repitió el experimento muchas veces, provocó otras reacciones, midiendo siempre con escalas la masa de las sustancias a ensayar y la masa de los productos obtenidos»1. Debido a esta y varias otras experiencias, concluyó que:
En un sistema cerrado, la masa total de reactivos es igual a la masa total de productos
Esta fue la primera de las leyes de las combinaciones químicas o leyes del peso y, de ella, han surgido otras para explicar las regularidades que ocurren en las combinaciones químicas, como la Ley de Proust y la Ley de Graham.
La ley de conservación de la pasta se puede demostrar en el laboratorio, sin necesidad de una mayor sofisticación instrumental, como se describe a continuación:
1. Coloque 10 ml de hidróxido de sodio (NaOH) a una concentración de 0,20 M dentro de un matraz Erlenmeyer. Agrega unas gotas de fenolftaleína. Habrá formación del característico color rosa.
dos. Introduzca 10 ml de ácido clorhídrico (HCl) con una concentración de 0,21 M en un tubo de ensayo. Deposite con cuidado este tubo dentro del matraz Erlenmeyer para que quede apoyado.
3. Cerrar el matraz Erlenmeyer con un tapón adecuado y colocar el juego sobre una balanza. Tenga en cuenta la masa inicial.
4. Incline con cuidado el erlenmeyer cerrado para permitir la salida del HCl contenido en el tubo de ensayo, que reacciona al entrar en contacto con el NaOH presente en el erlenmeyer, cambiando el color de la solución, según la siguiente ecuación de neutralización:
HCl(aquí) + NaOH(aquí) → NaCl(s) + HdosO(1)
5. Regrese el conjunto a la báscula. Anote la masa final y compárela con la inicial.
El experimento descrito anteriormente permite observar la conservación de la masa entre los reactivos y los productos en caso de una reacción química, identificada en este caso por el cambio de color, según afirma Lavoisier.
Referencias:
1. http://www.fem.unicamp.br/~em313/paginas/person/lavoisie.htm
FELTRE, Ricardo, Química General, Vol. I, Ed. Moderna, 6ª Ed., São Paulo / SP, 2004.
http://pt.wikipedia.org/wiki/Antoine_Lavoisier