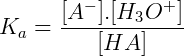Un ácido, según una de sus definiciones, es una especie química capaz de ionizarse, liberando iones de hidrógeno (H+) en un medio acuoso. Su identificación teórica puede estar relacionada con la presencia del elemento hidrógeno en su molécula, o experimentalmente debido a su propiedad de liberar este hidrógeno en estado gaseoso cuando se encuentra en una reacción química con un metal más reactivo que el hidrógeno.
A continuación se muestran dos ejemplos de ácidos de gran importancia, tanto para la industria como en el laboratorio de investigación, el primero un hidrácido (no tiene oxígeno en su molécula) y el segundo un oxiácido (tiene oxígeno).
HCl: ácido clorhídrico
HdosSOLO4: ácido sulfúrico
Cuando un ácido se ioniza en agua, ocurre un proceso de equilibrio, representado por:
HA + HdosO ↔ A– + H3O+
O, de forma simplificada:
HA A– + H+
El grado de ionización de un ácido se llama constante de acidez, y representado por ka. El nombre de la constante de ionización también se utiliza y se puede definir matemáticamente como se muestra a continuación:
Las especies representadas entre paréntesis representan sus concentraciones molares. Así, el cálculo de la constante de acidez considera el cociente entre el producto de la concentración molar de su base conjugada y su número de iones hidrógeno, por el de sus partículas no ionizadas. Por tanto, su valor de ka es directamente proporcional a la concentración iónica, lo que indica que cuanto mayor es el valor de ka para un ácido, mayor es su ionización y mayor es la fuerza de ese ácido.
La Tabla 1 muestra el valor constante de acidez para algunos ácidos, a una temperatura de 25 ° C (la temperatura interfiere significativamente con la ka de un ácido).
|
ÁCIDOS |
ka |
FUERZA ÁCIDA |
|
HCl |
10+7 |
Muy fuerte |
|
HdosSOLO4 |
10+3 |
Muy fuerte |
|
HdosSOLO3 |
1.5.10-dos |
Fuerte |
|
H3POLVO4 |
7.6.10-3 |
Débil |
|
HNOdos |
4.3.10-4 |
Débil |
|
HF |
3.5.10-4 |
Débil |
|
CH3COOH |
1.8.10-5 |
Débil |
|
HdosCO3 |
4.3.10-7 |
Débil |
|
Hdoss |
1.3.10-7 |
Débil |
|
HCN |
4.9.10-10 |
Muy débil |
Tabla 1. Constante de acidez de algunos ácidos 1.
En la parte superior de la tabla están los ácidos mencionados al principio de este texto. Tanto el ácido clorhídrico como el ácido sulfúrico son altos ka, siendo ácidos muy fuertes. Por otro lado, el ácido cianhídrico, por el contrario, tiene una baja ka, siendo un ácido muy débil. Así, podemos concluir que una solución de ácido clorhídrico o ácido sulfúrico tiene una gran parte de iones en solución, mientras que una solución a base de ácido cianhídrico tiene una gran parte de moléculas disueltas.
Experimentalmente, este comportamiento se puede verificar haciendo pasar dichas soluciones por una corriente eléctrica, componiendo un circuito capaz de encender una bombilla, por ejemplo. Se observa entonces que en todas las soluciones hay un paso de corriente eléctrica, pero la lámpara es más intensa cuanto más fuerte es el ácido (tiene mayor número de partículas iónicas en solución, responsables de la transmisión de la corriente eléctrica).
Referencias:
1. http://www.soq.com.br/conteudos/em/equilibrioquimico/p4.php
ATKINS, Peter; JONES, Loreta; Principios de la química: cuestionando la vida moderna y el medio ambiente, Porto Alegre: Bookman, 2001.