Tabla de contenidos
(latín medieval destilación, -onis)

El acto de destilar; proceso de separación de los componentes de una mezcla por ebullición.
QUÍMICA
La destilación es un proceso físico que consiste en separar, mediante calor, los distintos elementos que constituyen un líquido o un sólido, y recogerlos en forma gaseosa. Esta vaporización puede ir seguida de condensación por enfriamiento (licuefacción).
Durante casi mil años, la destilación se ha utilizado para la purificación de líquidos y la extracción de aromas de las plantas. Hoy en día, este proceso se utiliza para la refinación de petróleo, la fabricación de alcoholes y muchos productos industriales o metalúrgicos.
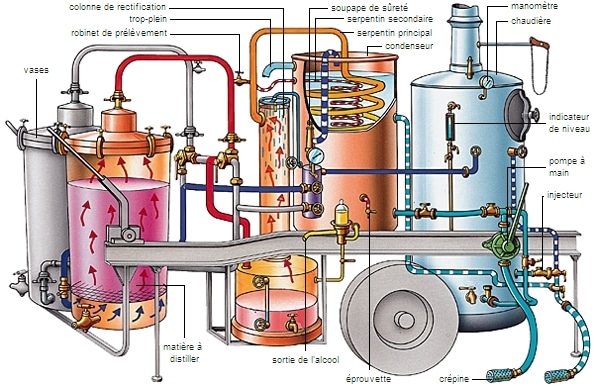
El aparato de destilación
El aparato utilizado para la destilación es el alambique, que consta de dos elementos: el primero (la caldera) es un tanque en el que se calienta y vaporiza el líquido; el segundo (el condensador) es un tubo, conectado al tanque, en el que el vapor se enfría y se condensa (licuefacción). Se forman gotas de líquido en las paredes del condensador, luego caen lentamente en otro tanque, el receptor.
Aplicaciones y procesos
Purificación del agua
Las baterías de automóviles, y algunos dispositivos utilizados en la industria química, requieren agua muy pura, que no contiene sales minerales y, por lo tanto, no pueden ser abastecidas por ríos, pozos o embalses. Por lo tanto, el agua se purifica por destilación: el agua mineral se calienta para que el agua se evapore, mientras que las sales permanecen en el fondo de la caldera; el vapor se enfría, se condensa y vuelve al estado líquido en el condensador; se recupera el agua desmineralizada (el destilado). Este proceso también se puede utilizar para obtener agua dulce a bordo de los barcos. Algunas plantas desalinizadoras de agua de mar operan con los mismos principios.
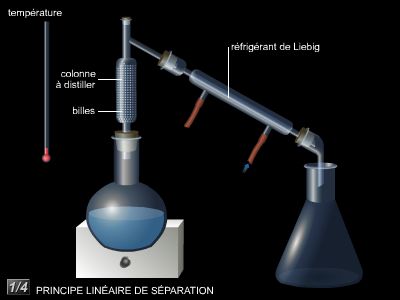
La separación de los componentes de una mezcla: destilación simple
A veces, un líquido se compone de una mezcla de varios líquidos. Así, el vino se compone de alcohol y agua, y de petróleo, gasolina, queroseno y varias especies de hidrocarburos, ligeros o pesados. Estos diferentes componentes líquidos pueden separarse mediante destilación: gracias a un riguroso control de temperatura, uno de los líquidos puede vaporizarse antes que otro cuyo punto de ebullición propio aún no se ha alcanzado. Por ejemplo, en el caso de una destilación de una mezcla de alcohol metílico (alcohol de madera) y agua, el alcohol metílico hierve a 65 ° C y el agua a 100 ° C. Si esta mezcla se calienta un poco por encima de 65 ° C, el alcohol metílico se vaporizará primero: una vez que el vapor se haya condensado, se recogerá alcohol metílico casi puro en el receptor (el líquido destilado contendrá una cantidad muy pequeña de agua, debido a lluvia de vapor). Este proceso, utilizado para líquidos con puntos de ebullición muy diferentes, se denomina destilación simple.
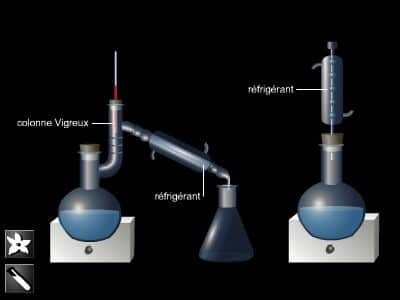
Destilación fraccionada
Cuando se trata de separar dos o más líquidos en una mezcla, se utiliza la destilación fraccionada. A medida que la mezcla se calienta, cada componente comienza a hervir cuando alcanza su punto de ebullición particular. A continuación, los vapores obtenidos se condensan y se recogen en condensadores y receptores separados. Por tanto, este método permite la separación de una mezcla líquida en porciones, llamadas fracciones. Ainsi, dans la distillation d’un mélange d’alcool éthylique et d’eau, la portion qui bout en deçà de 76,7 °C peut être une fraction, celle qui bout entre 82,2 °C et 100 °C en est otra.
Las fracciones suelen ser mezclas, pero pueden ser sustancias puras.
La industria, y más particularmente la metalurgia, también usa condensación fraccionada. La mezcla a destilar se calienta hasta que la mayoría de sus componentes se hayan vaporizado. El vapor se eleva en una columna donde cada fracción se condensa en diferentes puntos. Las fracciones a altas temperaturas de ebullición se condensan primero en la base de la columna. Aquellos con una temperatura de ebullición más baja deben subir más antes de que se enfríen lo suficiente como para condensarse.
Destilación a presión reducida
Algunos líquidos no pueden destilarse por métodos convencionales, porque serían destruidos por la temperatura antes de alcanzar su punto de ebullición: este es el caso de los aceites lubricantes. El ingeniero químico debe recurrir a la destilación al vacío parcial: al reducir la presión de un líquido, es posible bajar el punto de ebullición, de modo que la vaporización se produzca a una temperatura inferior a la de destrucción.
Cuando la destilación se lleva a cabo casi al vacío total, el proceso se denomina destilación molecular. Este tipo de destilación se utiliza en particular industrialmente para la purificación de vitaminas.
Destilación al vapor
La destilación al vapor se utiliza a veces para sustancias cuyas temperaturas de ebullición son bajas y que se deterioran fácilmente bajo la acción del calor. Al inyectarse vapor a presión en el alambique, el calor liberado vaporiza el líquido a destilar. Una vez que se ha producido la condensación, el vapor se convierte en agua en el condensador. Este proceso está reservado para líquidos inmiscibles con agua, como perfumes y aceites aromáticos de plantas.
Destilación seca o destructiva
La destilación seca, o destilación destructiva, se utiliza para separar los productos químicos líquidos de los materiales sólidos. Por tanto, es posible obtener, a partir de la madera, por calcinación, creosota (una mezcla de fenoles), alcohol metílico y muchos otros productos.
La destilación del carbón, según el mismo proceso, conduce a la producción de gas doméstico, alquitrán …
Algunos sólidos, cuando se someten a la acción del calor, en lugar de formar un líquido, se transforman directamente en vapor: esto es la sublimación, que es un proceso de destilación utilizado en particular para la purificación de yodo, sólido o azufre.
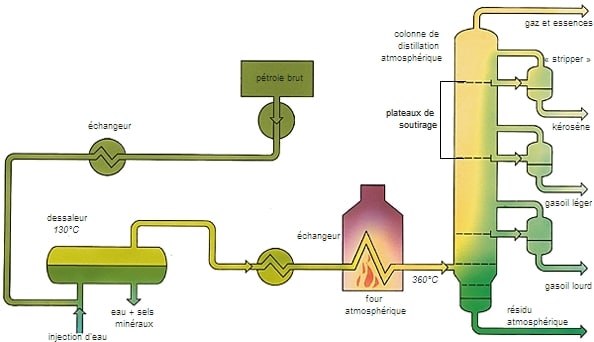
PETRÓLEO
En una refinería, el petróleo crudo se somete primero a una destilación fraccionada lo que resultó en una decena de recortes básicos de aceite. Luego, sus características se mejoran mediante plantas de conversión o purificación.
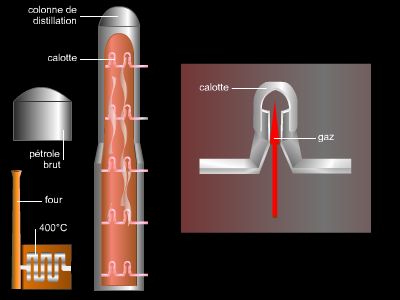
Brevemente, obtenemos, al disminuir la volatilidad, los siguientes productos:
– gas combustible (VS1, VS2),
– cortador de propano (VS3),
– cortador de butano (VS4),
– gasolina ligeraVS5, VS6, o 20-80 ° C),
– gasolina pesada (VS7Para VS10o 80-100 ° C),
– queroseno (180-230 ° C),
– dos o más gasóleos (230-380 ° C),
– varios destilados (380-500 ° C),
– un residuo de vacío (superior a 550 ° C).
El resultado se obtiene realizando tres operaciones: destilación atmosférica de crudo, separación de gases y gasolinas, destilación al vacío del residuo atmosférico.