El Enlace covalente o Molecular Bonding, son enlaces químicos en los que se comparte uno o más pares de electrones entre átomos, con el fin de formar moléculas estables, que según Teoría del octeto:
«un átomo adquiere estabilidad cuando tiene 8 electrones en la capa de valencia (capa electrónica más externa), o 2 electrones cuando solo tiene una capa«.
A partir de esto, a diferencia de los enlaces iónicos, en los que se produce la pérdida o ganancia de electrones, en los enlaces covalentes, que se producen generalmente entre los no metales (metales) de la tabla periódica, los pares electrónicos.
En otras palabras, el nombre que se le da a los electrones que da cada uno de los núcleos de los elementos, es el compartir de átomos que buscan obtener estabilidad. Los enlaces covalentes se clasifican en: Enlaces covalentes y Enlaces covalentes Doval.
¿Cuándo ocurren los enlaces covalentes?
Los enlaces covalentes ocurren cuando hay un intercambio de electrones entre átomos, lo que hace que todos los átomos que participan en este tipo de enlace sean estables, sin embargo, en el caso de enlace covalente coordinado o dativo, el átomo que tiene pares de electrones disponibles y que no los comparte con otro átomo puede «donar» estos electrones libres a cualquier otro átomo, realizando así un enlace covalente simple y un enlace covalente coordinado o dativo, donde se produce la transferencia de electrón (s) de un átomo a otro. Este tipo de enlace químico es bastante común y suele ocurrir con átomos de cloro, azufre, fósforo, entre otros diversos elementos químicos.
Para que se produzca un enlace covalente coordinado es necesario que uno de los átomos comparta un par de electrones con otro átomo, y al mismo tiempo, asignar uno o más electrones con otro átomo, que solo participa en el enlace que recibe el (los) electrón (es). Para que sea más fácil de entender, veamos cómo funciona este tipo de conexión:
El enlace covalente covalente ocurre solo si el átomo responsable de la donación de los electrones se estabiliza de acuerdo con la regla del octeto, es decir, primero ocurre el intercambio de electrones con un átomo, hasta que ambos son estables, porque solo después de que ocurre esta estabilización. la donación de electrones para que el otro átomo se estabilice.
Simbología de Lewis
En la simbología de Lewis, los enlaces donde tiene lugar la donación de electrones están representados por flechas (→) y los enlaces donde tiene lugar el intercambio de electrones están representados por un guión que conecta los electrones (• ─ •).
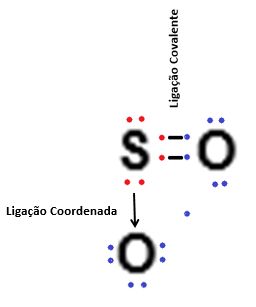
Estructura de dióxido de azufre (SOdos), con un enlace covalente coordinado.

Estructura de trióxido de azufre (SO3), con dos enlaces covalentes coordinados.
Para algunos elementos químicos, de acuerdo con su distribución electrónica, es posible predecir la cantidad de enlaces covalentes simples y coordinados que pueden ocurrir. Para elementos pertenecientes a las familias Hidrógeno, IVA, VA, VIA y VIIIA, es posible verificar información relacionada con enlaces covalentes, como se muestra en la siguiente tabla:
Tabla de enlaces covalentes simples y coordenadas |
|||||
| Tipo de conección | familia de elementos químicos | ||||
| Hidrógeno | IVA | IR | VÍA | VIIIA | |
| Numero de llamadas | |||||
| covalente simple | 1 | 4 | 3 | dos | 1 |
| Coordenada covalente | 0 | 0 | 1 | dos | 3 |
Los enlaces coordinados, tanto simples como coordinados, tienen una fuerza de enlace menor que los enlaces iónicos y metálicos. Por esta razón, los enlaces químicos son más sensibles y se rompen más fácilmente. Sin embargo, en algunos casos existen excepciones donde la fuerza de interacción entre las moléculas permite que algunas sustancias formadas por enlaces covalentes se encuentren en estado sólido, como el yodo, el carbono en forma de diamante y la sílice.
Los principales elementos químicos que participan en los enlaces covalentes son los no metales y semimetales: hidrógeno, boro, carbono, silicio, germanio, nitrógeno, fósforo, arsénico, antimonio, oxígeno, azufre, selenio, telurio, polonio, flúor, cloro, bromo, Yodo y Astatino.
Los enlaces covalentes pueden ser polares y apolares, dependiendo de la electronegatividad de los átomos que participan en el enlace químico. El enlace covalente de tipo polar se establece entre átomos con diferentes electronegatividades, mientras que el tipo no polar se establece entre átomos con la misma electronegatividad.
Ejemplos de enlaces covalentes
Como ejemplo de enlace covalente, tenemos la molécula de agua HdosO: H – O – H, formado por dos átomos de hidrógeno y uno de oxígeno en el que cada traza corresponde a un par de electrones compartidos formando una molécula neutra, ya que no hay pérdida ni ganancia de electrones en este tipo de enlace. Del mismo modo, los enlaces covalentes son los Odos (OO) y Fdos (FF).
Enlace covalente dativo
También llamado enlace coordinado o semipolar, el enlace covalente dativo es similar al enlace dativo, sin embargo se da cuando uno de los átomos tiene su octeto completo, es decir, ocho electrones en la última capa y el otro, para completar su estabilidad electrónica, necesita adquirir dos más. electrones. En otras palabras, el enlace covalente dativo ocurre cuando uno de los átomos comparte sus electrones con los otros dos elementos.
Representado por una flecha, un ejemplo de este tipo de enlace es el compuesto de dióxido de azufre SO2: O = S → O
Esto se debe a que se establece un doble enlace del azufre con uno de los oxígeno para lograr su estabilidad electrónica y, además, el azufre dona un par de sus electrones al otro oxígeno para que tenga ocho electrones en su valencia. Recuerde que la flecha indica que el azufre (S) está donando un par de electrones al oxígeno (O).
Lea mas: