Tabla de contenidos
Los enlaces químicos corresponden a la unión de átomos para la formación de sustancias químicas.
En otras palabras, los enlaces químicos ocurren cuando los átomos de los elementos químicos se combinan entre sí y los tipos principales son:
- Enlaces iónicos: transferencia de electrones;
- Enlaces covalentes: intercambio de electrones;
- Conexiones de metal: existencia de electrones libres.
Regla del octeto
La Teoría del Octeto, creada por Gilbert Newton Lewis (1875-1946), químico estadounidense, y Walter Kossel (1888-1956), físico alemán, surgió de la observación de gases nobles y de algunas características como, por ejemplo, la estabilidad de la elementos que cuentan 8 electrones en la capa valenciana.
Por lo tanto, la teoría o regla del octeto explica la aparición de enlaces químicos de la siguiente manera:
«Muchos átomos tienen estabilidad electrónica cuando tienen 8 electrones en la capa de valencia (capa electrónica más externa)».
Para ello, el átomo busca su estabilidad donando o compartiendo electrones con otros átomos, de donde surgen los enlaces químicos.
Vale la pena recordar que existen muchas excepciones a la Regla del Octeto, principalmente entre los elementos de transición.
Obtenga más información sobre la teoría del octeto.
Tipos de enlaces químicos
Enlace iónico
También llamado enlace electrovalente, este tipo de enlace se forma entre iones (cationes y aniones), de ahí el término «enlace iónico».
Para que se produzca un enlace iónico, los átomos implicados tienen tendencias opuestas: un átomo debe tener la capacidad de perder electrones mientras que el otro tiende a recibirlos.
Por lo tanto, un anión cargado negativamente se une a un catión cargado positivamente, formando un compuesto iónico a través de la interacción electrostática entre ellos.
Ejemplo: A+Cl– = NaCl (cloruro de sodio o sal de mesa). En este compuesto, el sodio (Na) dona un electrón al cloro (Cl) y se convierte en un catión (carga positiva), mientras que el cloro se convierte en un anión (carga negativa).
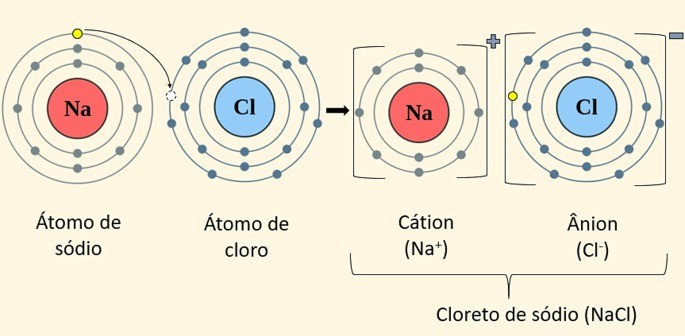
Otros ejemplos de sustancias formadas por enlaces iónicos son:
- Bromuro de potasio, KBr
- Cloruro de calcio, CaCldos
- Fluoruro de magnesio, MgFdos
Los compuestos iónicos se encuentran generalmente en estado sólido en condiciones ambientales y tienen altos puntos de fusión y ebullición. Cuando se disuelven en agua, estas sustancias pueden conducir una corriente eléctrica, ya que sus iones se liberan en solución.
Obtenga más información sobre la unión iónica.
Enlace covalente
También llamado enlace molecular, los enlaces covalentes son enlaces en los que se comparten electrones para la formación de moléculas estables, según la teoría del octeto; a diferencia de los enlaces iónicos donde se pierden o se ganan electrones.
Además, pares electrónicos es el nombre que se le da a los electrones asignados por cada uno de los núcleos, con el intercambio de electrones de enlaces covalentes.
Ejemplo: HdosO: H – O – H (molécula de agua) formada por dos átomos de hidrógeno y uno de oxígeno. Cada traza corresponde a un par de electrones compartidos que forman una molécula neutra, ya que no hay pérdida ni ganancia de electrones en este tipo de enlace.
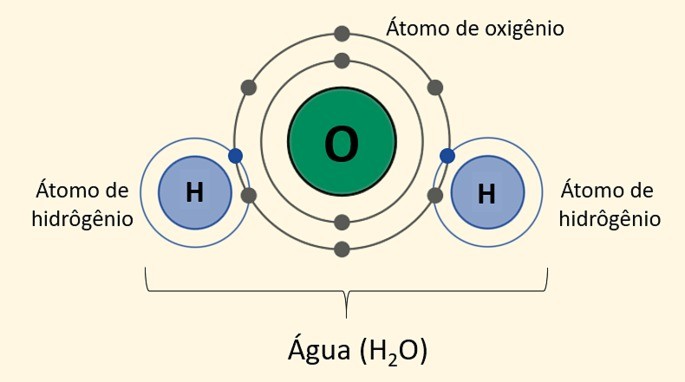
Otros ejemplos de sustancias formadas por enlaces covalentes son:
- Oxígeno gas, Odos
- Sacarosa (azúcar de mesa), C12H22O11
- Ácido clorhídrico, HCl
Los enlaces covalentes se pueden clasificar como polares o apolares. En el caso del agua, tenemos un enlace covalente polar, porque los átomos que componen la molécula tienen diferentes electronegatividades. Oxígeno (Odos) presenta un enlace covalente apolar, porque está formado por átomos de un solo elemento químico y, por tanto, no hay diferencia de electronegatividad.
Obtenga más información sobre los enlaces covalentes.
Enlace covalente dativo
También llamado enlace coordinado, ocurre cuando uno de los átomos tiene su octeto completo, es decir, ocho electrones en la última capa y el otro, para completar su estabilidad electrónica, necesita adquirir dos electrones más.
Este tipo de enlace está representado por una flecha y un ejemplo es el compuesto dióxido de azufre SOLOdos: O = S → O.
Esto se debe a que se establece un doble enlace del azufre con uno del oxígeno para lograr su estabilidad electrónica y, además, el azufre dona un par de sus electrones al otro oxígeno para que tenga ocho electrones en su capa de valencia.
Obtenga más información sobre la capa de valencia.
Conexión Metálica
Es la conexión que se da entre metales, elementos considerados electropositivos y buenos conductores térmicos y eléctricos. Por lo tanto, algunos metales pierden electrones de su última capa llamada «electrones libres», formando así cationes.
A partir de esto, los electrones liberados en el enlace metálico forman una «nube electrónica», también llamada «mar de electrones» que produce una fuerza que hace que los átomos del metal permanezcan juntos.
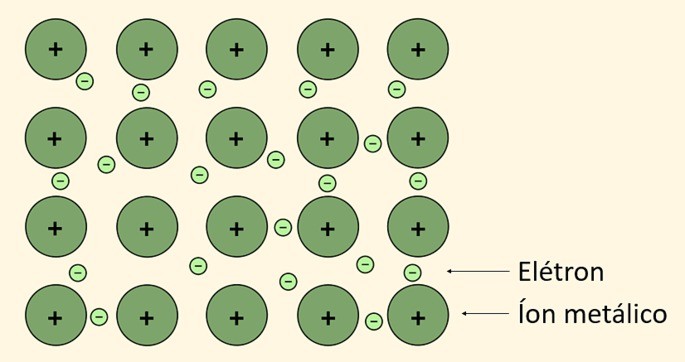
Ejemplos de metales: Oro (Au), Cobre (Cu), Plata (Ag), Hierro (Fe), Níquel (Ni), Aluminio (Al), Plomo (Pb), Zinc (Zn), entre otros.
Los metales presentan un estado físico sólido a temperatura ambiente, a excepción del mercurio, único metal líquido en estas condiciones. Las sustancias metálicas son buenos conductores de calor y electricidad y, además, tienen un brillo característico.
Obtenga más información sobre la conexión metálica.
Ejercicios sobre enlaces químicos (con resolución)
Pregunta 1
Según la Regla del Octeto, para adquirir la estabilidad que presenta un gas noble, el átomo de un elemento químico cuyo número atómico es 17 debe:
a) gana 2 electrones
b) perder 2 electrones
c) ganar 1 electrón
d) perder 1 electrón
Para obtener más preguntas, consulte Ejercicios de enlaces químicos.
Pregunta 2
¿Entre las sustancias (I) etanol, (II) dióxido de carbono, (III) cloruro de sodio y (IV) gas helio que solo tienen enlaces químicos interatómicos de tipo covalente?
a) I y II
b) II y III
c) I y IV
d) II y IV
Lea también sobre moléculas polares y apolares.
Pregunta 3
Una de las principales características de los metales es la alta capacidad para conducir calor y electricidad, lo que puede explicarse por:
a) existencia de más electrones que protones
b) existencia de electrones libres
c) existencia de más de un tipo de enlace químico
d) existencia de diferentes protones libres
Lea mas:





