“Propiedades físicas” es una expresión de significado muy amplio: engloba todas las propiedades de las sustancias relacionadas con los fenómenos físicos. No tendría sentido intentar estudiar todas las propiedades físicas a la vez; solo enumerarlos todos consumiría una gran cantidad de espacio. En general, establecimos objetivos prácticos para delimitar nuestros estudios: las propiedades físicas que nos interesan en este momento son las que usamos habitualmente en trabajos de laboratorio comunes, como punto de fusión, punto de ebullición, solubilidad. Estas propiedades están fuertemente asociadas con las fuerzas que mantienen unidas a las moléculas, llamadas fuerzas intermoleculares.
fuerzas intermoleculares
El enlace que mantiene a los átomos dentro de una molécula es el enlace covalente. Las fuerzas de atracción entre moléculas son de naturaleza eléctrica. Las fuerzas gravitacionales también existen, pero podemos descartarlas por ser mucho más pequeñas que las fuerzas eléctricas. Ahora veamos las fuerzas que existen entre moléculas.
Estas fuerzas se pueden dividir en dos tipos: Van der Waals y enlaces de hidrógeno.
Las fuerzas de van der Waals
Fuerzas de atracción o repulsión entre entidades moleculares (o entre grupos dentro de la misma entidad molecular) distintas de las que se deben a la formación de enlaces o la interacción electrostática de iones o grupos iónicos entre sí o con moléculas neutras.
Estudiemos dos tipos principales:
Fuerza entre dipolos permanentes: Si la molécula de la sustancia contiene un dipolo permanente (debido a la polaridad de uno o más de sus enlaces covalentes), entonces podemos ver fácilmente cómo estas moléculas se atraen entre sí: el lado positivo del dipolo de una molécula atrae el lado negativo del dipolo de la otra molécula. Por tanto, esta fuerza existe entre moléculas polares (μtotal ≠ 0).
Ejemplo:
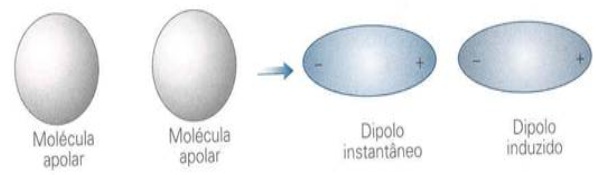
Fuerzas de Londres o fuerzas de dispersión: Y cuando las moléculas no contienen dipolos (no son polares), ¿cómo pueden atraerse entre sí? Piense en una molécula como una entidad no estática pero que contiene electrones en constante movimiento; es razonable pensar que en un momento dado la distribución en esta molécula puede no ser perfectamente simétrica, y entonces aparecen pequeños dipolos instantáneos en ese momento. Estos dipolos desaparecerán en muy poco tiempo y pueden dar lugar a una molécula neutra oa otros dipolos, incluso opuestos; pero en el poco tiempo que existen, pueden inducir la formación de dipolos opuestos en la molécula vecina, haciendo que los dos se atraigan entre sí. Ejemplo:
Enlaces de hidrógeno: El átomo de hidrógeno tiene propiedades especiales porque es un átomo muy pequeño, sin electrones en su interior: dentro de la capa de valencia solo está el núcleo del átomo, el protón. Una de las propiedades que solo tiene el átomo de hidrógeno es la capacidad de ejercer una fuerza de atracción intermolecular llamada enlace de hidrógeno. El enlace de hidrógeno solo puede ocurrir cuando el hidrógeno está unido a un átomo pequeño y muy electronegativo, como F, O, N, Cl, etc. Cuando el hidrógeno está unido a un átomo muy electronegativo, la densidad de electrones alrededor del protón es muy baja; esta parte de la molécula es entonces fuertemente atraída por los pares de electrones del átomo electronegativo de otra molécula, estableciendo el enlace de hidrógeno.
Ejemplo:
Los enlaces de hidrógeno juegan un papel importante tanto en las propiedades especiales del agua como en las moléculas de extrema importancia para los seres vivos: determinan la forma de las proteínas y constituyen la fuerza que une las hélices del ADN.