Tabla de contenidos
LA Geometría molecular se basa en la forma espacial que asumen las moléculas por la disposición de los átomos enlazados. Así, cada molécula tiene una forma geométrica característica de la naturaleza de los enlaces (iónicos o covalentes) y los constituyentes (como los electrones de valencia y electronegatividad).
Teoría de la repulsión electrónica de pares
La teoría de repulsión de pares electrónicos de valencia (TRPEV) señala que los pares electrónicos (electrones de valencia, ligandos o no) del átomo central se comportan como nubes electrónicas que se repelen entre sí y, por tanto, tienden a mantener la mayor distancia posible entre ellos. otros. Pero, como las fuerzas de repulsión electrónica no son suficientes para romper el enlace entre los átomos, esta distancia se verifica en el ángulo que se forma entre ellos.
Formas geometricas
Para facilitar la determinación de la geometría (y estructura) de una molécula, se deben seguir los siguientes pasos:
- Recuento del número total de electrones de valencia (teniendo en cuenta la carga, si es un ion);
- Determinación del átomo central (generalmente, el menos electronegativo y con el mayor número de enlaces);
- Contando el número de electrones de valencia de los átomos de enlace;
- Cálculo del número de electrones no vinculantes (diferencia entre el número total y el número de electrones de los átomos vinculantes con la capa de valencia completamente completa);
- Aplicación del modelo TRPEV.
Así, las geometrías más habituales obtenidas (principalmente observando los pares electrónicos no vinculantes) son:
| Geometría | Pares electrónicos totales | Pares electrónicos no vinculantes | Pares electrónicos de ligandos |
| Lineal | dos 5 6 |
0 3 4 |
dos dos dos |
| Triangular | 3 | 0 | 3 |
| Angular | 34 | 12 | 22 |
| tetraédrico | 4 | 0 | 4 |
| Piramidal | 4 | 1 | 3 |
| bipiramidal | 5 | 0 | 5 |
| octaétrico | 6 | 0 | 6 |
Nota: cada molécula biatómica asume una geometría lineal. Y, solo las geometrías lineales, triangulares y angulares son planas: las otras son espaciales.
Modelos moleculares

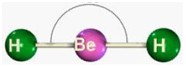
geometría lineal

Geometría triangular

geometría angular

geometría tetraédrica

geometría piramidal

geometría bipiramidal

geometría octaédrica
Fuentes:
http://www.moderna.com.br/pnlem2009mg/quimica/canto/volumes/pdfs/a1_7.pdf
http://www.spq.pt/boletim/docs/boletimSPQ_103_025_15.pdf
http://pt.wikipedia.org/wiki/Molecular_Geometry
http://quimica10.com.br/10/wp-content/uploads/2009/01/10-e28093-geometria-e-polaridade-molecular.pdf
Exámenes de ingreso y exámenes
Pregunta 01: (PUC-RIO 2008)
Según la teoría de la repulsión de los pares electrónicos de la capa de valencia, los pares de electrones alrededor de un átomo central se repelen y se orientan a la mayor distancia angular posible.
Considere que los pares de electrones alrededor del átomo central pueden ser un enlace covalente (simple, doble o triple) o simplemente un par de electrones libres (sin enlace).
Con base en esta teoría, es correcto afirmar que la geometría molecular del dióxido de carbono es: