A reacciones de halogenación se refieren a aquellos en los que un átomo de cualquier elemento de la familia 7A (halógenos – F, Cl, Br e I) reemplaza un átomo de hidrógeno, o incluso reduce la insaturación de un enlace entre carbonos (eliminando un enlace pi).
La halogenación puede presentarse como una sustitución (cuando un átomo de hidrógeno en realidad da paso a un átomo de halógeno) o como una adición (cuando reduce el número de enlaces pi entre los carbonos y conserva el número de átomos de hidrógeno).
Halogenación por adición
Las moléculas orgánicas que tienen al menos un enlace insaturado (doble o triple) participan en reacciones de adición cuando entran en contacto con halógenos (en su forma molecular o como haluros de hidrógeno – HX).
De acuerdo con la regla de Markovnikov, cuando se agrega un haluro de hidrógeno de tipo HX, el hidrógeno se une al carbono más hidrogenado del enlace insaturado. Hasta el punto de que el halógeno se une a otro carbono (menos hidrogenado).
Como ejemplo, observe la reacción de adición entre propileno (propeno, según la nomenclatura IUPAC) y cloruro de hidrógeno:
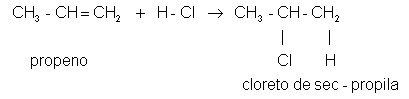
Como predijo la regla de Markovnikov, el hidrógeno en la molécula de HCl se une al carbono 1 en la molécula de propeno (más hidrogenado por el doble enlace), mientras que el cloro se une al carbono 2 (secundario).
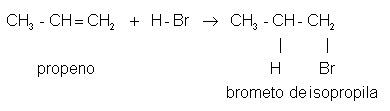
Sin embargo, no siempre se sigue la regla de Markovnikov. Un ejemplo es la formación de bromuro de isopropilo, donde el hidrógeno en la molécula de HBr se une al carbono secundario (menos hidrogenado por insaturación):
Cuando la especie a halogenar es alcalina, se puede formar un producto doblemente halogenado (dihaluro) si el reactivo HX está en exceso.
El siguiente diagrama representa la hidratación (adición de HX) de una molécula de metil acetileno con exceso de bromuro de hidrógeno:
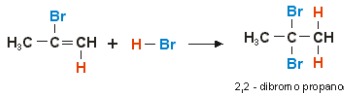
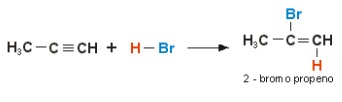 Como todavía hay bromuro de hidrógeno en el medio, se produce otra reacción de halogenación con la adición de HBr:
Como todavía hay bromuro de hidrógeno en el medio, se produce otra reacción de halogenación con la adición de HBr:
Halogenación por sustitución
Cuando un alcano o un aromático reacciona con una molécula de halógeno, se produce la llamada reacción de sustitución. Porque, solo uno de los átomos de la molécula de halógeno se une a la molécula orgánica. Por tanto, un hidrógeno migra y se forma un haluro de hidrógeno como producto.
Tomemos el ejemplo de la bromación de una molécula de propano:
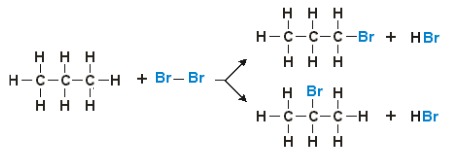
Como puede verse, se pueden obtener dos productos diferentes (isómeros). Sin embargo, se puede inferir que la segunda forma es la más abundante: por tanto, se obtiene experimentalmente que hay un aumento en la tendencia del hidrógeno a ser sustituido cuando hay un aumento en el número de enlaces saturados de un átomo de carbono. Por tanto, es más probable que un hidrógeno unido a un carbono terciario sea reemplazado por un halógeno en comparación con un hidrógeno de carbono primario o secundario de la misma molécula.
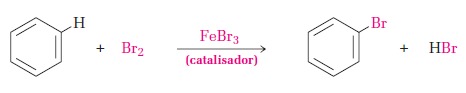
En aromáticos, la halogenación rara vez ocurre en ausencia de catalizadores. Debido a que estos ayudan en la «migración» del halógeno a través de un ataque electrofílico en el anillo (según la teoría ácido-base de Lewis):
Bibliografía:
PERUZZO, Francisco Miragaia. CANTO, Eduardo Leite. La química en el enfoque cotidiano: química orgánica, São Paulo. Moderna, 2006. 4ª edición.
http://www.moderna.com.br/didaticos/em/quimica/cotidiano/aluno/qui_organica/mec03.pdf (consultado el 14/08/2010)
http://www.ebah.com.br/halogenacao-doc-a51705.html (consultado el 14/08/2010)
http://www.soq.com.br/conteudos/em/reacoesorganicas/p1.php (consultado el 14/08/2010)