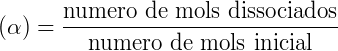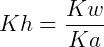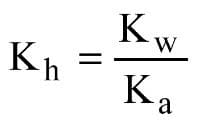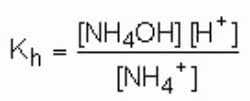La hidrólisis es un proceso químico que implica la descomposición de una molécula en presencia de agua. Recuerda que el término «hidro«Significa agua y»lisis”Está relacionado con la rotura.
Este proceso es común en química (reacciones) y también en biología (hidrólisis de enzimas y proteínas).
XY + HdosO → HY + XOH
Esta acción del agua no ocurre sola, para eso son necesarias la presión y la alta temperatura. Además, para aumentar la velocidad, se debe usar un agente acelerador, un catalizador, los más importantes de los cuales son ácidos, enzimas y álcalis.
La hidrólisis tiene aplicaciones tanto en reacciones orgánicas como inorgánicas. En general, podemos destacar las reacciones de saponificación de ácidos grasos, inversión de azúcares, preparación de alcoholes y ácidos a partir de ésteres, hidrólisis de productos naturales como almidones, glucósidos, proteínas.
Es importante resaltar que el proceso de hidrólisis no debe confundirse con la deshidratación, ya que en el primero la rotura de la molécula es provocada por la presencia de agua, mientras que en el segundo proceso ocurre la formación de moléculas de agua. La hidrólisis puede ser de tipo alcalino, ácido, salino o enzimático.
La hidrólisis alcalina o básica se produce en presencia de una base en una solución acuosa, que puede diluirse o concentrarse. La base se usa en lugar de agua, ya que libera OH– y al final de la reacción, se utilizan sal y ácido como productos. Entre las aplicaciones de la hidrólisis básica se encuentran reacciones de formación de ésteres, hidrólisis de muestras de sedimentos, digestión de materiales orgánicos utilizando hidróxidos de potasio (KOH) o sodio (NaOH) y reacción de despolimerización de la botella de PET.
La hidrólisis ácida se produce en presencia de un ácido mineral en una solución acuosa, que puede diluirse o concentrarse. Los principales ácidos utilizados son el ácido sulfúrico (HdosSOLO4) y ácido clorhídrico (HCl), pero en algunos casos también se puede utilizar ácido nítrico (HNO)3) y fosfórico (H3POLVO4). Entre las aplicaciones de la hidrólisis ácida se encuentran las reacciones que involucran ésteres, amidas y azúcares. Un ejemplo práctico es la descromatización ácida, que consiste en eliminar el cromo presente en los desechos de cuero antes de su eliminación, evitando la contaminación del suelo o las aguas subterráneas.
La hidrólisis enzimática ocurre en presencia de enzimas, que actúan como catalizadores, aumentando la velocidad de las reacciones, ya que promueve una disminución de la energía de activación (energía necesaria para iniciar la reacción). Cuando se compara con la hidrólisis ácida y básica, tiene la ventaja de ser específico, tener control del grado de hidrólisis, condiciones de reacción más moderadas, concentraciones más bajas de reactivos. Algunos ejemplos de aplicación son la descomposición de proteínas (proteasas, que ayudan en la ruptura de enlaces peptídicos), hidrólisis de aceites y grasas (lipasas, descomposición de moléculas lipídicas en colesterol, ácidos grasos y glicerol), digestión de carbohidratos (sacarasa, descomposición de la sacarosa en glucosa y fructosa) e hidrólisis enzimática de biomasa para la producción de etanol.
La hidrólisis salina se define como la reacción entre una molécula de sal y agua.
YX(s) + HdosO(l) ↔ Y(aq)+ + X(aq)–
Los iones que forman la sal, al reaccionar con agua de carácter anfótero, pueden resultar en una solución ácida, básica o neutra.
Formación de una solución ácida:
H+ + HdosO ↔ HOH + H+
Formación de una solución básica:
OH– + HdosO ↔ HOH + OH–
Los ácidos o bases formados son de carácter moderado o débil. Es posible calcular el grado (α) y la constante de hidrólisis (Kh) como se describe a continuación:
Donde Kw = constante de disociación del agua y Ka = constante de disociación ácida.
Entre las aplicaciones de la hidrólisis salina podemos destacar el tratamiento de aguas, y diversos análisis cuantitativos utilizados en laboratorios de investigación e industrias.
hidrólisis salina
En química, la hidrólisis de la sal tiene lugar entre una sal y agua. Esta reacción reversible produce un ácido y una base correspondientes. Las soluciones acuosas de ácidos tienen un pH inferior a 7 y las de bases un pH superior a 7.
Los iones presentes en las sales se disocian en presencia de agua y pueden formar ácidos o bases:
Sal + Agua ↔ Ácido + Base
Recuerde que la sal es siempre iónica y el agua es molecular. Por lo tanto, el agua se ioniza en aniones hidróxido (OH–) y cationes de hidrógeno (H+). Asimismo, la sal se disocia y libera aniones y cationes.
Tenga en cuenta que una sal ácida fuerte forma una solución ácida:
Ejemplo: H+ + HdosO ↔ HOH + H+
Una sal base fuerte forma una solución básica:
Ejemplo: Oh– + HdosO ↔ HOH + OH–
Un ejemplo de aplicación de la hidrólisis salina es el bicarbonato de sodio, que está presente en medicamentos que combaten la acidez de estómago.
Esto se debe a que la solución de NaHCO3 es básico, ya que se sometió a hidrólisis del anión HCO–3:
HCO–3 + HdosO ↔ HdosCO3 + OH–
Grado y constante de hidrólisis
En equilibrio químico, siempre se definen un grado y una constante. Así grado de hidrólisis (α) se mide mediante la expresión:
Lea también: Número de mol y masa molar.
LA constante de hidrólisis viene dada por la siguiente expresión:
Ser,
Kh: constante de hidrólisis
Kw: producto iónico del agua (aproximadamente 10-14 a temperatura ambiente)
K (a o b): constante ácida o básica
Teniendo en cuenta las siguientes reacciones químicas, vea a continuación un ejemplo de hidrólisis de NH4Cl:
NUEVA HAMPSHIRE4Cl + HdosO ↔ HCl + NH4Oh
NUEVA HAMPSHIRE+4 + HdosO ↔ H+ + NH4Oh
Por tanto, la constante de hidrólisis de NH4Es: