En los fenómenos de difusión, cuando un soluto es transportado por un líquido o fluido gaseoso de un medio más concentrado a uno menos concentrado, o por ósmosis (cuando el fluido involucrado es agua), los términos hipertónico y hipotónico definen el análisis de movimiento y dirección de partículas cuando se separan de un medio con diferente concentración.
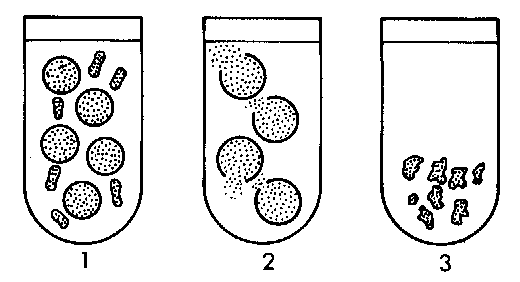
Un medio hipertónico es precisamente aquel que presenta una mayor concentración de soluto en relación a otro medio. Esto, a su vez, es hipotónico en relación con el primero. Por lo tanto, estas clasificaciones solo pueden usarse en un sentido comparativo y no como una definición primaria de la característica osmótica de una solución.
Ejemplos:
1) En un caso extremo, al poner sal doméstica en algunas hojas de lechuga, se puede observar que después de un tiempo se marchitan. Esto se debe a que el agua presente en las hojas fluye para disolver la sal agregada: por lo tanto, la sal actuaría como un medio hipertónico en relación con las hojas de lechuga; mientras que lo mismo que un medio hipotónico.
Es de destacar que no se aplica la clasificación de la sal como solución altamente concentrada, ya que se encuentra en estado sólido. La clasificación como medio asume una posición más aceptable.
2) Un glóbulo rojo (la célula que forma la sangre) se encuentra en estado turgente cuando se coloca en un medio hipotónico en relación con él. De esta forma, el agua fluye de afuera hacia adentro (a diferencia del flujo del ejemplo anterior) y existe el riesgo de que el glóbulo rojo se rompa (hemólisis).
3) Si la célula en cuestión fuera de una planta, por existir una pared celular suficientemente resistente, solo presentaría turbidez o plasmólisis (cuando se inserta en un medio hipertónico).
La ósmosis inversa, como su nombre indica, se produce cuando se elimina un disolvente de un soluto a través de una presión determinada (contrariamente al gradiente de concentración, el principio de existencia de difusión en general). Por tanto, se utiliza una membrana permeable únicamente al disolvente.
Algunos ejemplos de ósmosis inversa son:
- Desalinización de agua de mar (aunque se pueden utilizar otros métodos para la separación);
- Desmineralización de agua para la producción y uso de fármacos en procedimientos clínicos (como hemodiálisis);
Esta técnica se vuelve más viable técnica y económicamente cuando los solutos son de masa molecular baja. Dado que la presión suministrada es relativamente alta y el proceso puede ser muy lento.
Fuentes:
http://www.hsw.uol.com.br/questao29.htm (acceso el 29/05/2011)
http://www.geafiltration.com/Portuguese/Tecnologia/osmose_reversa.htm (acceso el 29/05/2011)