La estabilidad energética de un elemento aumenta a medida que se llena la capa más externa de su átomo. Esto se puede hacer «ganando» o «perdiendo» electrones a otros átomos. Ocurrirá lo que sea energéticamente más favorable para el átomo. Por ejemplo, a un elemento que finaliza su configuración electrónica en nosotrosdosnotario público5será suficiente recibir un electrón para que se complete su capa de valencia. Este elemento luego se clasificará como no metálico, cuyo átomo tiene un alto número de electrones en la capa de valencia. Para un elemento de configuración que termina en nosotros1, la pérdida de este electrón periférico hará que su capa sea anterior a la de valencia, aumentando la estabilidad de su átomo. Este elemento se clasificará luego como un metal, cuyo átomo tiene un número bajo de electrones en la capa de valencia. Tal discusión tiene en cuenta la estabilidad de un gas noble.
Quizás la ilustración más sorprendente de la periodicidad química se encuentra en la variación a lo largo de un período en la tabla periódica de la relación de combinación atómica entre un elemento dado y los elementos del período. Esta periodicidad estequiométrica, en particular, llevó a los químicos a descubrir la ley periódica. “La relación en la combinación de átomos en compuestos ilustra la periodicidad química de una manera espectacular. LA tabla 1 muestra las fórmulas de algunos compuestos de cloro. La proporción varía de 1: 1 en los cloruros del grupo IA a 1: 4 en los cloruros del grupo IVA, y de nuevo a 1: 1 en los cloruros del grupo VIIA. (Cloro gaseoso, Cldos, está incluido en la tabla, aunque no es un compuesto.) Esta periodicidad atrajo la atención de Mendeliev y Meyer desde el principio ”.1.
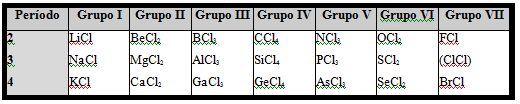
TABLA 1. Relaciones en combinaciones atómicas de compuestos con cloro1.
Sin embargo, se observan numerosas excepciones, y la posición ocupada en la tabla periódica no siempre es indicativa del número de enlaces químicos que realiza el elemento, ocurriendo también la existencia de elementos capaces de formar diferentes compuestos, variando su proporción en estos.
Por ejemplo, el elemento químico hierro (Fe) tiene una variabilidad del número de oxidación (NOX) de +2 y +3, y esta variación conduce a compuestos como el cloruro ferroso (FeCldos) y cloruro férrico (FeCl3). Tenga en cuenta que los sufijos hueso indica el NOX más bajo y el sufijo ich indica el más grande. El elemento químico cobre varía en NOX entre +1 y +2, formando cloruro cuproso (CuCl) y cloruro cúprico (CuCldos). Nótese que estos dos elementos químicos (Fe y Cu) fueron discutidos debido a su normalidad con respecto a la formación de compuestos con alta diversidad y ocurrencia.
Referencias:
1. RUSSELL, John B .; Química General vol.1, São Paulo: Pearson Education of Brazil, Makron Books, 1994.
SARDELLA, Antonio; MATTHEW, Edegar; Curso de Química: química general, Ed. Ática, São Paulo / SP – 1995.
MAHAN, Bruce M .; MYERS, Rollie J .; Química: un curso universitario, Ed. Edgard Blucher LTDA, São Paulo / SP – 2002.