Tabla de contenidos

Proteína del suero sanguíneo secretada por células plasmáticas, derivada de linfocitos (glóbulos blancos implicados en la inmunidad humoral) tipo B en reacción a la introducción en el organismo de una sustancia extraña (antígeno).
Al nacer, el recién nacido tiene algunas de las inmunoglobulinas de su madre (solo IgG), que atraviesan la placenta durante el embarazo y persisten durante unos meses. Otros le son traídos por la leche materna. Poco a poco, crea su propia inmunidad (especialmente IgA), porque su sistema inmunológico madura y entra en contacto con los antígenos que lo rodean.
Diferentes tipos de inmunoglobulina.
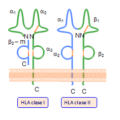
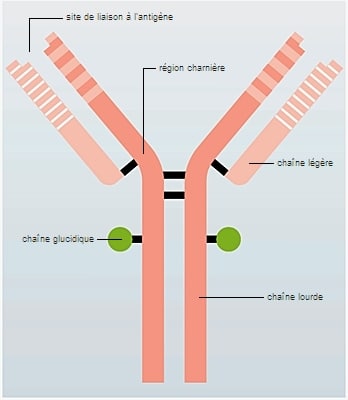
Una inmunoglobulina está formada por 4 cadenas de aminoácidos (o polipéptidos), donde hay dos llamadas cadenas ligeras y dos llamadas pesadas. Para cada inmunoglobulina, las 2 cadenas pesadas son idénticas entre sí, al igual que las 2 cadenas ligeras. La estructura de cadena pesada define cinco clases de inmunoglobulinas: inmunoglobulinas de tipo G, o IgG (12 gramos por litro de sangre), IgA (2 gramos por litro), IgM (1 gramo por litro), IgD (0,2 gramos por litro) e IgE. (de 250 a 450 nanogramos por litro).
IgA Desempeñan un papel importante en la lucha contra bacterias y virus en las membranas mucosas (tracto respiratorio o digestivo, por ejemplo). Su vida útil es corta pero, como se reemplazan rápidamente, es la IgA la que más sintetiza el organismo.
IgD intervenir en la maduración de los linfocitos.
IgE tienen un papel clave en la defensa contra los parásitos y en el mecanismo de la alergia. Se secretan contra los alérgenos y hacen que el organismo libere histamina, sustancia responsable de la aparición de los síntomas de la alergia (asma, por ejemplo).
IgG se producen durante el contacto prolongado con un antígeno o durante un segundo contacto del organismo con un antígeno. Es la respuesta de la memoria, el principio por el cual funcionan la inmunidad adquirida y las vacunas. Su afinidad por el antígeno es más fuerte que la de IgM.
IgM son inmunoglobulinas secretadas durante el primer contacto del cuerpo con un antígeno. Su afinidad por el antígeno es menor que la de las IgC.
Función
Una inmunoglobulina es capaz de unirse específicamente al antígeno que provocó su síntesis, y solo a él; luego toma el nombre de anticuerpo. Por tanto, una inmunoglobulina producida contra el virus del sarampión no podrá reconocer la de la poliomielitis. Las inmunoglobulinas neutralizan los antígenos e inducen su destrucción por el complemento (sistema enzimático) o por las células fagocíticas (macrófagos, linfocitos T, neutrófilos polimorfonucleares, monocitos) que a su vez se unen a las inmunoglobulinas. La estructura que asocia un antígeno y uno o más anticuerpos dirigidos contra él se denomina «inmunocomplejo».
Son posibles analogías entre dos antígenos que, por tanto, son reconocidos por el mismo anticuerpo: hablamos de mimetismo molecular. Por ejemplo, un antígeno de virus puede parecerse a un autoantígeno (específico del organismo infectado). Los anticuerpos, cuya síntesis se habrá desencadenado por la presencia del virus, también reconocerán el autoantígeno, que puede conducir a una enfermedad autoinmune.
Uso terapéutico
Las inmunoglobulinas, de origen animal o humano, son uno de los fármacos utilizados en inmunoterapia. Están indicados en la prevención y tratamiento de enfermedades infecciosas (tos ferina, hepatitis A y B, paperas, rabia, rubéola, tétanos, varicela, herpes; en este caso, las inmunoglobulinas se extraen del suero de un sujeto convaleciente), en casos de inmunodeficiencia global (inmunoglobulinas inespecíficas, provenientes de un gran número de donantes) y en la prevención de la incompatibilidad Rhesus. Administrados por vía subcutánea, intramuscular o intravenosa lenta, ofrecen una protección rápida pero de duración limitada. También participan en el tratamiento de determinadas enfermedades autoinmunes.
Ver : anticuerpo, gammaglobulina.