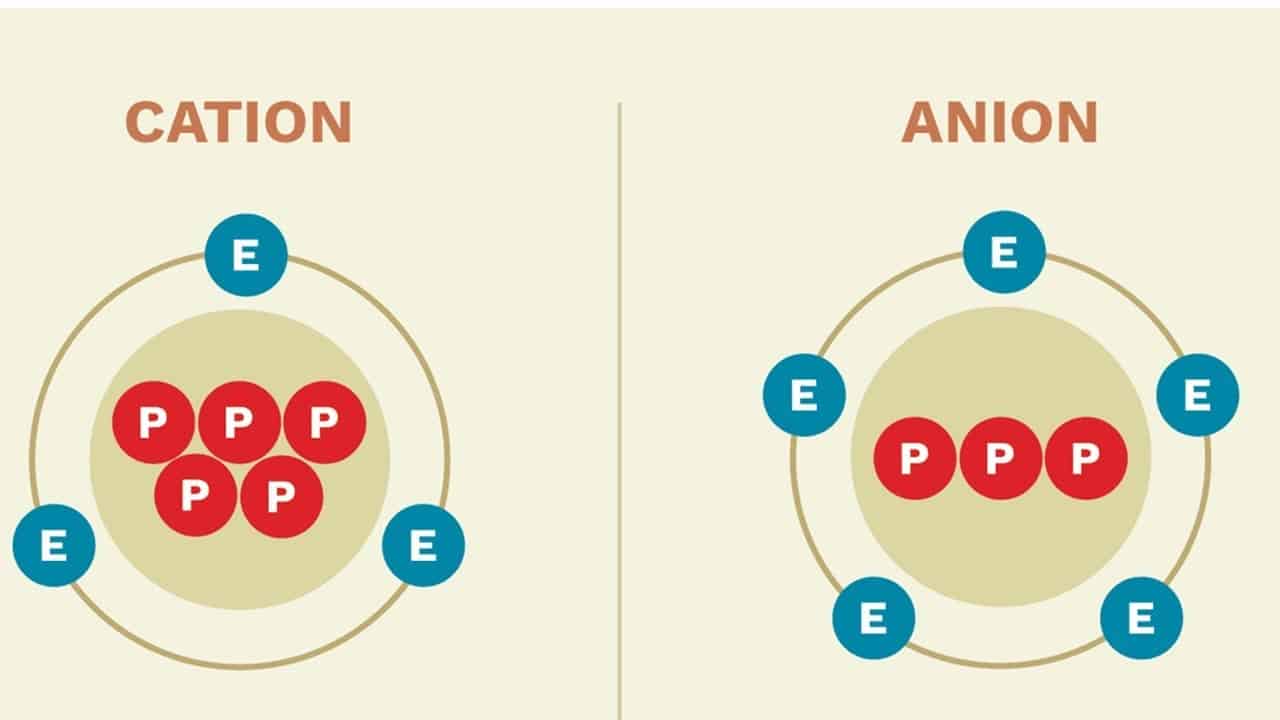
Uno ion es un átomo que tiene un déficit o exceso de electrones. Para el primer caso, adquiere una carga positiva (catión). Para el segundo, carga negativa (anión), ya que la carga del electrón se llama negativa. En otras palabras, la ganancia o pérdida de electrones de un átomo lo elimina de la neutralidad y le da carga eléctrica.
A pesar de estar cargados eléctricamente, los iones pueden tener mayor estabilidad que los átomos neutros: el ion fluoruro (F–), por ejemplo, se deriva de un átomo de flúor que ha recibido 1 electrón y, por tanto, ha adquirido una carga negativa. Pero, como la adición de éste hace que su capa de valencia tenga 8 electrones, según la regla del octeto, adquiere estabilidad eléctrica.
Es decir, el hecho de que este ion posiblemente se una a un catión no tiene como objetivo la estabilidad eléctrica, como ya se ha alcanzado, sino por atracción electrostática. Así, en una posible separación, tanto la F– cuánto permanecería estabilizado el catión.
Potencial de ionización
El potencial de ionización, o energía de ionización, de un átomo es la energía mínima necesaria para que un electrón sea eliminado de su electrosfera cuando se encuentra en un estado gaseoso y no excitado. Así, cuanto mayor sea esta energía, menor será la tendencia de este átomo a convertirse en catión.
Los halógenos son los elementos que tienen mayor potencial de ionización. A diferencia de los metales en general.
Afinidad electrónica
A diferencia del potencial de ionización, la afinidad electrónica mide la tendencia de un átomo gaseoso no excitado a aceptar la adición de un electrón a su electrosfera. Por lo tanto, determina la tendencia de un átomo a convertirse en anión, donde a mayor afinidad electrónica, más energía se libera por la entrada de este electrón.
Por tanto, los metales tienen valores más bajos, en módulo, de energía liberada que los halógenos.