Tabla de contenidos
isotopía
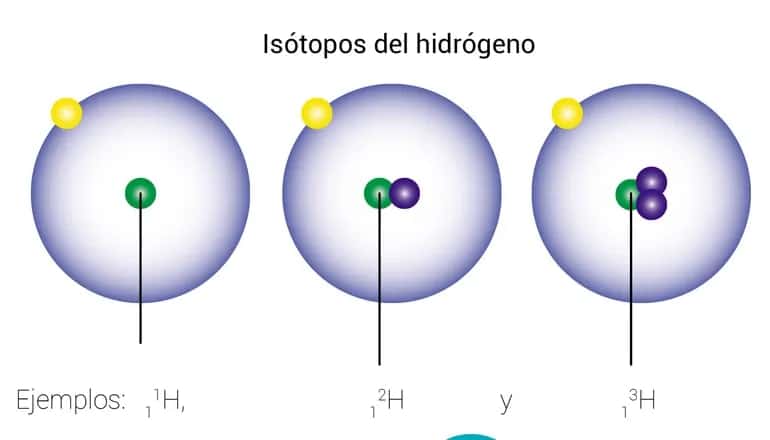
Los átomos de los elementos químicos pueden tener números atómicos idénticos, pero números de masa diferentes, ya que contienen diferentes cantidades de neutrones. Llamamos átomos con este isótopo característico átomos, es decir, tienen la misma cantidad de protones. Varios elementos químicos tienen isótopos, sin embargo, el hidrógeno es el único que tiene una nomenclatura especial para cada uno de sus tres isótopos.
El hidrógeno tiene tres isótopos, llamados protio, deuterio y tritio. Veamos a continuación lo que los distingue entre sí:
| protio | Deuterio | tritio | |
| 1H1 | 1Ddos | 1T3 | |
| n = 0 | n = 1 | n = 2 | |
| Ocurrencia: | 99,985% | 0,015% | 10-7% |
Los otros elementos que tienen isótopos no tienen nomenclaturas especiales como el hidrógeno, los identificamos solo por su número de masa, por ejemplo:
| Carbono 12 6C12 n = 6 |
carbono 13 6C13 n = 7 |
Carbono 14 6C14 n = 8 |
| Oxígeno 16 8Odieciséis n = 8 |
Oxígeno 17 8O17 n = 9 |
Oxígeno 18 8O18 n = 10 |
Entonces podemos concluir que los isótopos son átomos de los mismos elementos químicos que tienen el mismo número de protones y diferente número de masa y neutrones.
Los radioisótopos son átomos que tienen núcleos radiactivos y, cuando se transforman en un isótopo, liberan energía en forma de radiación, llamadas partículas alfa, partículas beta o radiación gamma. El carbono 14 mencionado anteriormente es un radioisótopo de carbono, que se utiliza ampliamente en la datación de fósiles y la investigación de aguas subterráneas.
Isobaria
Los átomos de diferentes elementos químicos pueden tener idénticos números de masa, pero diferentes números atómicos, ya que contienen diferentes cantidades de neutrones. Llamamos átomos con esta característica átomos isobáricos, es decir, átomos que tienen la misma cantidad de masa. Veamos algunos ejemplos:
| Carbono 14 6C14 n = 8 |
Nitrógeno 7norte14 n = 7 |
| Potasio 19K40 n = 21 |
argón 18Aire40 n = 22 |
Entonces podemos concluir que las isobaras son átomos de diferentes elementos químicos que tienen el mismo número de masa.
isotonía
Son átomos de diferentes elementos químicos que tienen idénticos números de neutrones, pero diferentes números atómicos. Llamamos átomos con esta característica átomos isotónicos, es decir, tienen la misma cantidad de neutrones. Veamos algunos ejemplos:
| Carbono 14 6C14 n = 8 |
Oxígeno 8Odieciséis n = 8 |
| Boro 5B11 n = 6 |
Carbón 6C12 n = 6 |
Entonces podemos concluir que los isotonos son átomos de diferentes elementos químicos que tienen el mismo número de neutrones.
isoelectrónica
Son átomos de diferentes elementos químicos que tienen idéntico número de electrones. Llamamos átomos con esta característica átomos isoelectrónicos, es decir, tienen el mismo número de electrones. Pueden ser átomos, cationes o aniones neutros. Veamos algunos ejemplos:
| Catión de magnesio 12mg2+ electrones = 10 |
Anión de flúor 9F-1 electrones = 10 |
| Catión de calcio 20Aquí2+ electrones = 18 |
Anión de fósforo 15PAG-3 electrones = 18 |
Entonces podemos concluir que la isoelectrónica son átomos o iones neutros de diferentes elementos químicos que tienen el mismo número de electrones.
En la siguiente tabla podemos ver las diferencias estudiadas en este contenido:
| Similitud atómica | Número de protones (Z) | Número de masa (A) | Número de neutrones (n) | Número de electrones (e) |
| Isótopos | = | ≠ | ≠ | ≠ |
| ISOBARS | ≠ | = | ≠ | ≠ |
| ISOTONAS | ≠ | ≠ | = | ≠ |
| ISOELECTRÓNICA | ≠ | ≠ | ≠ | = |
Referencias:
BUSHING, G. Química Mínimaanual: Teoría y Práctica. 2. Rev. Ed. São Paulo: Rideel, 2003.
http://adm.online.unip.br/img_ead_dp/21667.PDF
Los iones isoelectrónicos son iones que tienen el mismo número de electrones. Marque la opción donde las tres especies cumplen esta condición: