Tabla de contenidos
Conceptualmente, isótopos son átomos que tienen el mismo número de protones, es decir, son especies diferentes del mismo elemento, difiriendo sólo en el número de masa y neutrones.
Los isótopos en general tienen las mismas propiedades químicas, ya que este tipo de propiedad solo depende del número atómico, como es el caso de la solubilidad. Sin embargo, pueden tener diferentes propiedades físicas debido a sus diferentes masas, como es el caso de la densidad.
Los isótopos de un mismo elemento tienen diferentes abundancias naturales, es decir, se encuentran en la naturaleza en diferentes cantidades. El cálculo de la masa de un elemento químico se realiza utilizando la masa y la abundancia natural de cada isótopo de ese elemento. Por tanto, el isótopo más abundante es el que más contribuye a las características químicas del elemento de la Tabla Periódica.
Por ejemplo: el cloro tiene dos isótopos:
| Isótopo | Abundancia isotópica (%) | Masa relativa (u) |
| Cl35 | 75,76 | 34,969 |
| Cl37 | 24,24 | 36,966 |
La masa atómica relativa del cloro viene dada por el promedio ponderado de sus abundancias isotópicas:
La masa redondeada que observamos para el oxígeno en la Tabla Periódica es 16u., Siendo este valor una mayor contribución (99,75%) del isótopo de masa 15,994u. que de sus otros dos isótopos, O17 es el18.
Los radioisótopos son átomos que tienen un núcleo radiactivo, que puede liberar radiación al transformarse en otro isótopo (desintegración radiactiva). Estos isótopos se utilizan ampliamente en diversas aplicaciones, desde la obtención de energía hasta la medicina para tratamientos de radioterapia.
El uso de radioisótopos en el tratamiento del cáncer generalmente se realiza uniendo uno de estos radioisótopos a una molécula que lo lleva a la célula cancerosa. Cuando el radioisótopo se descompone, emite radiación que ioniza el ADN de la célula cancerosa e inhibe su crecimiento.
Isótopos importantes:
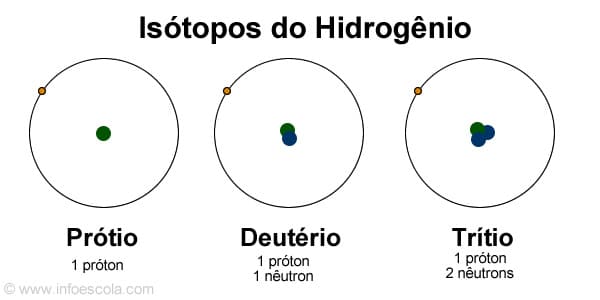
Isótopos de hidrógeno
El elemento hidrógeno tiene 3 isótopos conocidos, a saber:
- 1H1 – protio (alrededor del 99,98%)
- 1Hdos – deuterio – hidrógeno que tiene un neutrón (aproximadamente 0,015%).
- 1H3 – tritio – hidrógeno que tiene dos neutrones, y es radiactivo (solo trazas).
Isótopos de carbono
El carbono tiene dos isótopos naturales:
- 6C12 – carbono 12, más abundante en la Tierra (alrededor del 98,89%).
- 6C13 – carbono 13, menos abundante (alrededor del 1,01 al 1,14%).
- 6C14 – El carbono 14, único rastro en la naturaleza, es radiactivo y por ello se utiliza para realizar el proceso de datación de artefactos geológicos.
¿Cómo funciona la datación por carbono 14?
La técnica de datación por carbono 14 fue descubierta en la década de 1940 por Willard Libby. Usó un contador Geiger para medir la radiactividad de C-14 en varios objetos y notó que la cantidad de C-14 decae a un ritmo constante después de la muerte de un organismo vivo. Analizó artefactos con datación documentada y los comparó con la radiación que observó, pudiendo así determinar la edad promedio del artefacto. Esta técnica se considera viable para objetos de hasta 70.000 años de antigüedad y es aplicable a madera, carbono, sedimentos orgánicos, huesos, conchas marinas, es decir, cualquier material que contenga carbono en algunas de sus formas y lo absorba, aunque sea indirectamente, como alimentando organismos fotosintéticos de la atmósfera.