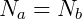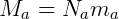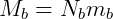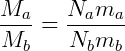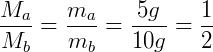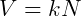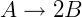Amedeo Avogadro fue un científico italiano que es mejor conocido por su contribución a la convocatoria. Ley de Avogadro. La ley establece que dos gases en las mismas condiciones de temperatura, presión y volumen contienen el mismo número de moléculas.
A pesar de parecer un enunciado simple, esta ley tiene un gran impacto en la teoría molecular y permite obtener la masa relativa de moléculas en fase gaseosa. Considere dos gases A y B a la misma temperatura y presión y almacenados en recipientes de igual volumen.
Dado que las condiciones son las mismas en los contenedores, podemos decir que:
Donde N representa el número de moléculas de cada tipo. Podemos relacionar la masa total del sistema con el número de moléculas usando la masa de cada molécula individual.
Es decir, la masa total de cada gas (M) es igual al número de moléculas (N) multiplicado por la masa de una sola molécula (m). Dividiendo las dos expresiones tenemos:
Observando la primera relación, tenemos que:
Es posible concluir que la masa de una molécula A es la mitad de la masa de una molécula B. A través de experimentos cuidadosos es posible establecer relaciones entre masas de diferentes gases, todavía podemos usar un determinado gas como referencia para los demás. Considere la siguiente propuesta.
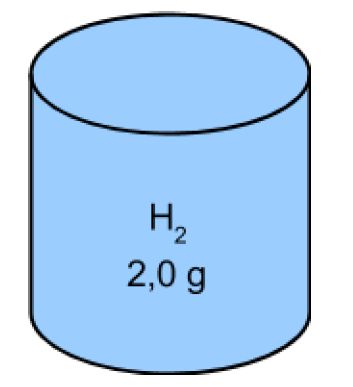
En un recipiente tenemos 2.0 g de hidrógeno gaseoso, en este matraz tenemos varias moléculas de NH2 que vamos a definir como 1 mol. Entonces, en el matraz de hidrógeno de 2.0 g tenemos 1 mol de moléculas. Aunque no conocemos la masa de una molécula de hidrógeno, en esta definición podemos establecer su masa molar, su masa por mol. En este caso 2,0 g por mol. Usando este valor podemos asignar masas molares a otros compuestos, oxígeno Odos por ejemplo, tendría una masa molar de 32 g / mol, nitrógeno Ndos tendría 28 g / mol.
Para relacionar mol con la cantidad real de moléculas necesitamos saber NH2, de hecho, este número se llama Número de Avogadro y se determinó experimentalmente que era 6.022 x 1023 moléculas / mol. Hoy en día, este número se define como la cantidad de átomos de carbono en una muestra de 0.012 kg del elemento.
La ley de Avogadro a menudo se interpreta como una relación entre el volumen y el número de partículas en un gas. Matemáticamente podemos escribir
Donde k es una constante de proporcionalidad. Las situaciones en las que varía el número de moléculas suelen estar relacionadas con reacciones químicas. Considere la siguiente reacción:
Una molécula de A se descompone en 2 moléculas B. Si el experimento se realiza a presión y temperatura constantes, podemos decir que el volumen final será el doble del volumen inicial. Si se desconoce el coeficiente estequiométrico de B, se puede utilizar este método para obtenerlo.