La ley de Boyle, también llamada ley de Boyle-Mariotte, se refiere a transformaciones isotérmicas en un gas ideal, es decir, transformaciones que ocurren a temperatura constante.
Esta ley se puede enunciar como:
En una transformación isotérmica, el volumen será inversamente proporcional a la presión, es decir, el producto del volumen por la presión será igual a un valor constante.
Esta conclusión fue concebida de forma independiente por el químico y físico irlandés Robert Boyle (1627-1691) y por el químico francés Edme Mariotte (1620-1684).
Cuando un gas real se somete a valores de baja presión y alta temperatura, su comportamiento termodinámico es cercano al de un gas ideal, por lo que se puede aplicar la ley de Boyle.
Fórmula
Según la ley de Boyle, considerando la temperatura constante en una transformación de gas, tenemos la siguiente relación:
pV = K
Ser,
p: presión (N / mdos)
V: volumen (m3)
K: un valor constante
Esta relación también se puede escribir considerando dos estados diferentes del mismo gas:
PAG1V1 = pdosVdos
Ejemplo
Un gas ideal se somete a una presión de 1,5 atm. Manteniendo la temperatura constante, ¿cuál es el valor de presión al que se debe someter para que su volumen se duplique?
Solución
Dado que es un gas ideal y la transformación indicada es una isoterma, podemos aplicar la ley de Boyle. Llamemos al volumen inicial V. Entonces, tenemos:
Por lo tanto, la presión debe ser igual a 0,75 atm para que el volumen del gas duplique su valor.
Gráfico
Podemos representar una transformación isotérmica a través de una gráfica de la variación de presión en función del volumen. Como existe una proporción inversa entre estas dos cantidades, el gráfico será una hipérbola.
La curva obtenida se denomina isoterma y representa el comportamiento del volumen y la presión de un gas para una temperatura determinada.
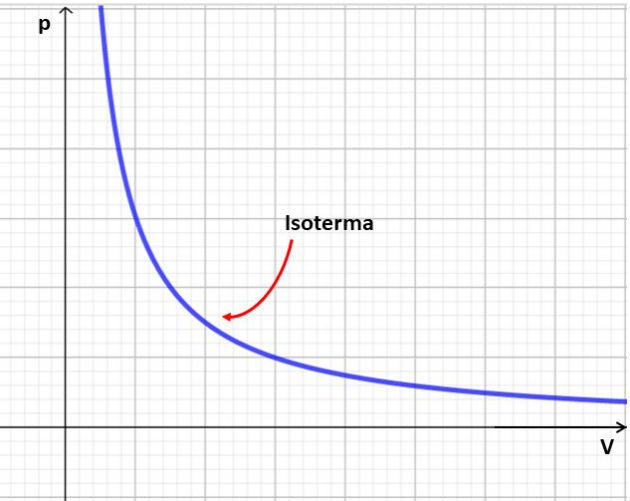
Tenga en cuenta que el gráfico muestra una variación opuesta entre las cantidades, es decir, cuando aumenta el volumen, la presión disminuye.
Ejercicios resueltos
1) UFRGS – 2017
Considere que una cierta cantidad de gas ideal, mantenida a temperatura constante, está contenida en un recipiente cuyo volumen se puede variar. Marque la alternativa que mejor represente el cambio de presión (p) que ejerce el gas, en función del cambio de volumen (V) del recipiente.
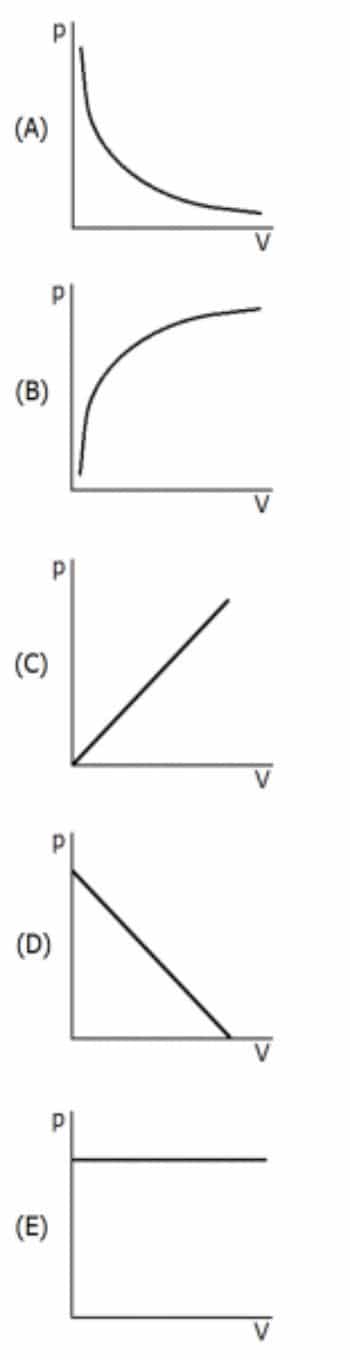
2) PUC / RJ – 2017
Un pequeño globo esférico flexible, que puede aumentar o disminuir de tamaño, contiene 1,0 litros de aire y se sumerge inicialmente en el océano a una profundidad de 10,0 m. Se lleva lentamente a la superficie, a temperatura constante. El volumen del globo (en litros), cuando llega a la superficie, es
Detalles: pCajero automático = 1,0 x 105 Pensilvania; ρAgua = 1,0 x 103 kg / m3 ; g = 10 m / sdos
a) 0,25
b) 0,50
c) 1.0
d) 2.0
e) 4.0
3) Unicamp – 2017
Hacer un vacío significa eliminar el aire existente en un volumen cerrado. Este proceso se utiliza, por ejemplo, para conservar los denominados alimentos envasados al vacío o para crear entornos controlados para experimentos científicos. La siguiente figura representa un pistón que se utiliza para hacer un vacío en una cámara de volumen constante VC = 2,0 litros. El pistón, conectado a la cámara por una válvula A, aumenta el volumen que puede ser ocupado por el aire en forma de VPAG = 0,2 litros. Luego, la válvula A se cierra y el aire dentro del pistón se expulsa a través de una válvula B, conectada a la atmósfera, completando un ciclo de bombeo. Considere que el aire se comporta como un gas ideal y que, durante el ciclo completo, la temperatura no varió. Si la presión inicial en la cámara es PI = 33 Pa, la presión final en la cámara después de un ciclo de bombeo será
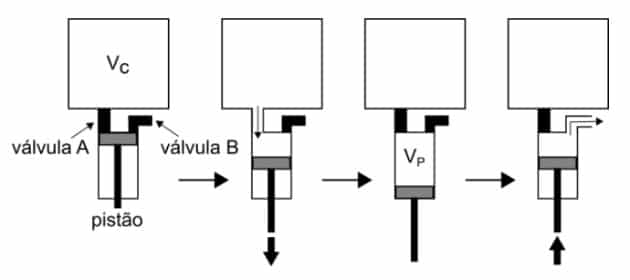
a) 30,0 Pa.
b) 330,0 Pa.
c) 36,3 Pa.
d) 3,3 Pa.
Lea también sobre el Transformaciones gaseosas.