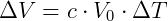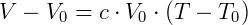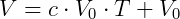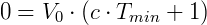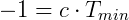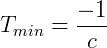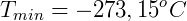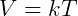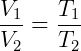Jacques Alexandre César Charles fue un científico francés que notó un cierto patrón en la expansión de los gases cuando se sometió a un aumento de temperatura. Aunque el estudio y la formulación de la ley fue realizado por Gay-Lussac, a Charles se le atribuyó su trabajo inédito.
LA Charles Law se aplica para transformaciones de gas donde la presión se mantiene constante. Por tanto, la relación entre volumen y temperatura está establecida por esta ley. El primer resultado importante de estos estudios fue el descubrimiento de que el coeficiente de expansión es aproximadamente el mismo para varios gases bajo el mismo rango de temperatura, podemos decir hoy que estos gases son los que tienen un comportamiento cercano al ideal. La relación entre la variación de volumen y la variación de temperatura se puede equiparar utilizando el coeficiente de expansión de la siguiente manera:
Dónde 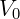
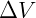
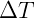
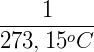
Aunque la expresión anterior es una forma útil de predecir el comportamiento de los gases, la mayor contribución de este descubrimiento fue la observación de que reducir la temperatura de un gas hasta cierto punto hará que su volumen sea nulo. En un principio esto se interpretó como una falla de la ley, por lo que no se aplicaría a temperaturas muy bajas, donde el volumen se reduciría a cero. Sin embargo, William Thomson, más conocido como Lord Kelvin, utilizó esta idea para establecer una escala de temperatura absoluta. Según Kelvin, habría una temperatura mínima que se puede alcanzar, donde, desde el punto de vista actual, cesaría el movimiento de las moléculas. Podemos demostrar esto con la ecuación anterior de la siguiente manera:
Utilizando la temperatura de 0 ºC como temperatura de referencia tenemos:
Haciendo V = 0:
De esta manera Kelvin postuló el cero absoluto y propuso una escala de temperatura absoluta, que hoy llamamos escala de Kevin, donde 0 K = -273,15 ºC y 273,15 K = 0 ºC.
El uso de la temperatura en la escala absoluta simplifica todas las expresiones para gases, la ley de Charles se puede escribir de la siguiente manera:
Donde k es una constante de proporcionalidad y la temperatura T se da en Kelvin. Alternativamente, dos estados se pueden relacionar de la siguiente manera:
Cuál es una forma conveniente de utilizar la ley de Charles en el estudio de transformaciones bajo presión constante.