Joseph Louis Gay-Lussac fue un químico y físico francés famoso por sus estudios sobre los gases, la composición del agua y el comportamiento de las mezclas de alcohol y agua, dando lugar este último a la escala Gay-Lussac (ºGL) para el volumen alcohólico.
Entre sus trabajos, una contribución muy importante a la comprensión de los sistemas gaseosos fue la conclusión de que la presión de un gas confinado a un volumen constante es proporcional a su temperatura. En lenguaje matemático esto equivale a:
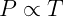
Donde P se usa típicamente para representar presión y T temperatura. Podemos convertir esta relación de proporcionalidad en igualdad usando una constante arbitraria k para escribir la relación:
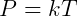
En principio, esta constante debe determinarse experimentalmente para cada gas. Sin embargo, se observa que dos gases sometidos a las mismas condiciones iniciales (presión, temperatura y volumen) tendrán k idénticos, esto significa que ambos sistemas responderán de manera similar a los cambios de temperatura. Esta es la primera sugerencia de la posibilidad de escribir el comportamiento de todos los gases con una ley más general.
Aunque la constante k puede contener información sobre el gas, es inconveniente cuando desea hacer predicciones sobre un estado futuro del sistema. Sin embargo, este problema puede superarse estableciendo una relación entre el estado inicial y final del gas sometido a una transformación isocórica, donde el volumen se mantuvo constante.
Para el estado inicial vale la pena:
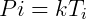
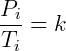
En el estado final, de manera similar:
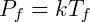
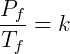
Tenga en cuenta que la constante k no cambia en este tipo de transformación, por lo que podemos hacer coincidir los términos para obtener la forma más útil de la ley:
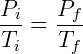
Entonces podemos enunciar el Ley de Gay-Lussac como:
Para las transformaciones isocóricas, las relaciones de presión y temperatura del gas antes y después son las mismas.
Si queremos estudiar cómo cambia la presión en relación con la temperatura podemos escribir:
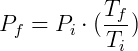
Podemos concluir que cualquier cambio de temperatura cambiará la presión en la misma proporción. Por ejemplo, considere que en una transformación dada duplicamos la temperatura. Entonces tendremos:
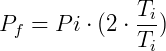
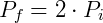
Al duplicar la temperatura, también duplicamos la presión. Recuerde que la temperatura siempre debe usarse en Kelvin (K).
Ahora veamos qué pasa si reducimos la temperatura a la mitad:
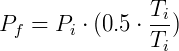
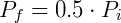
La presión también se reducirá a la mitad. Esta observación sigue siendo válida para cualquier gas ideal que experimente transformaciones en las que el volumen y la cantidad de materia sean constantes. Si decidimos variar la presión, la temperatura seguirá el cambio en la misma proporción, como se esperaba.
La ley de Gay-Lussac establece una relación útil para estudiar las transformaciones isocóricas. Además, las ecuaciones estudiadas proporcionan una base para la elaboración de la ley de los gases ideales.