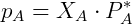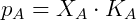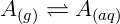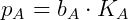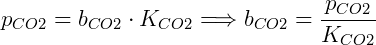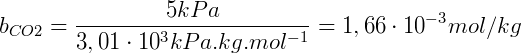Algunas soluciones cuyos componentes son volátiles respetan una relación que dice que la relación entre la presión de vapor parcial de cada componente y la presión de vapor del componente puro es aproximadamente igual a la fracción molar del componente en cuestión. Esta relación fue descrita por el químico francés François Raoult, y las soluciones de este tipo se denominan soluciones ideales. La expresión matemática de esta relación, llamada Ley de Raoult es:
Dónde 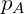
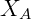
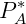
Se observó que en soluciones diluidas reales la presión de vapor también es proporcional a la fracción molar del componente, sin embargo, la constante de proporcionalidad no es la presión de vapor de la sustancia pura sino una constante empírica. Esta relación se conoce como Ley de Henry y establece que:
Dónde 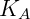
La ley de Henry permite, entre otras cosas, el estudio de la solubilidad de los gases. Es posible notar que la cantidad de gas disuelto es proporcional a la presión de ese gas en la superficie de la solución. Esto es consistente con la noción de equilibrio químico, donde podemos imaginar la reacción de disolver el gas A en agua:
Como era de esperar, el aumento de presión de A(gramo) debe aumentar la cantidad de A(aquí). La segunda observación experimental es que la constante de Henry disminuye con la temperatura. Esto puede explicarse por la agitación térmica, las soluciones más calientes tienen una agitación molecular más alta y, por lo tanto, el gas se libera del líquido con mayor facilidad.
Para aplicaciones prácticas, la ley de Henry se usa en una forma ligeramente diferente. La fracción molar del compuesto se reemplaza por la molalidad, representada por b:
Donde la molalidad se define como la cantidad de moles de soluto dividida por la masa de solvente en kilogramos.
La siguiente tabla presenta algunos valores de K para gases a 25 ° C:
| Gas | K (kPa.kg.mol-1) |
| COdos | 3,01 x 103 |
| Hdos | 1,28 x 105 |
| nortedos | 1,56 x 105 |
| Odos | 7,92 x 104 |
Como se puede ver en la ecuación anterior, cuanto menor es K, más soluble es el gas. Luego vemos que, para las moléculas de la tabla, que son no polares, cuanto más grande y más polarizable es su estructura, mayor es su solubilidad en agua.
Como ejemplo, podemos obtener la solubilidad del COdos con los datos de la tabla considerando que se aplica una presión parcial de 5 kPa sobre la solución:
La cual se puede expresar en concentración molar conociendo la densidad de la solución, asumiendo que la solubilidad del CO es 1.00 kg / Ldos en estas condiciones es 1,66 mmol / L.
Referencia
ATKINS, PW; PAULA, Julio de. Fisicoquímica. 8. ed. Río de Janeiro: LTC, 2008. 2 v. ISBN 9788521616009 (v.1).