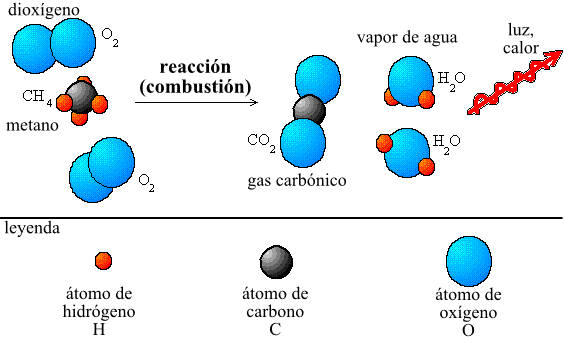
LA Ley de Lavoisier se refiere a la conservación de la materia durante una transformación física o química. Fue descubierto por el químico francés Antoine Lavoisier. Pero, antes de enunciarlo, mira el ejemplo:
La síntesis de amoníaco que se usa hoy en día solo fue posible gracias a las contribuciones de Fritz Haber y Carl Bosch. Consiste en la reacción de hidrógeno (Hdos) y nitrógeno (Ndos) gaseoso a muy alta presión (alrededor de 200 veces la presión atmosférica) y temperatura (alrededor de 500 ° C):
norte2 (g) + 3 H2 (g) ↔ 2 NH3 (g) ∆H = -92 kJ
La relación molar de esta reacción es 1: 3: 2. Así, 1 mol de nitrógeno reacciona con 3 mol de hidrógeno generando 2 mol de amoníaco.
Con la masa molar de nitrógeno igual a 28 g / mol, hidrógeno 2 g / mol y amoniaco 17 g / mol, se puede establecer una relación entre las masas de los reactivos y el producto:
28 gramos de Ndos + 6 gramos de Hdos ↔ 34 gramos de NH3
Así, en cada reacción de síntesis se forman 34 gramos de amoniaco y, como la reacción es reversible, cada reacción de descomposición forma 28 gramos de nitrógeno y 6 gramos de hidrógeno. También siendo el total de 34 gramos de producto.
Por tanto, así es como se enuncia la ley de Lavoisier:
Al final de una reacción química, la masa total inicial de los reactivos es igual a la masa total final de los productos. O en otras palabras, la masa se conserva independientemente de los cambios químicos y / o físicos que sufre la materia: en la naturaleza no se crea nada y no se pierde nada. Todo cambia.
Si bien esta ley se aplica convenientemente en sistemas cerrados (sin interferencia del ambiente externo), en los sistemas abiertos estaría presente una posible falla: cuando una barra de hierro se expone a un ambiente atmosférico húmedo, después de algún tiempo, se corroe. Sin embargo, en lugar de tener la misma masa, es más pesado.
Vale la pena recordar que cuando el hierro entra en contacto con un ambiente atmosférico húmedo (reaccionando con agua en estado de vapor y oxígeno gaseoso), forma depósitos de óxido en la superficie del metal:
Fe(s) → Fe2+ + 2e– (oxidación de hierro)
Odos + 2HdosO + 4e– → 4OH– (reducción de oxígeno)
2Fe + Odos + 2HdosO → 2Fe (OH)dos (ecuación general de formación de óxido)
Así, por cada 56 gramos de hierro que se corroe (reacciona con el agua y el oxígeno), se producen 90 gramos de hidróxido ferroso. Por tanto, la ley de Lavoisier sigue siendo válida incluso en entornos abiertos o en situaciones en las que al menos uno de los reactivos no está controlado.