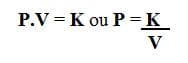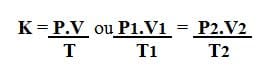Tabla de contenidos
LA Ley de los gases fueron creados por físicos entre los siglos XVII y XIX. A tres leyes de los gases son llamados:
- Ley de Boyle (transformación isotérmica)
- Ley de Gay-Lussac (transformación isobárica)
- Charles Law (transformación isométrica)
Cada uno de ellos contribuyó a los estudios sobre gases y sus propiedades, a saber: volumen, presión y temperatura.
¿Qué son los gases?
Tú gases son fluidos que no tienen forma ni volumen, es decir, la forma y el volumen de los gases dependen directamente del recipiente en el que se insertan.
Esto se debe a que las moléculas de gas, a diferencia de los sólidos, están separadas entre sí.
Gases ideales
La llamada «Gases ideales«O»Gases perfectos”Son modelos idealizados, utilizados para facilitar el estudio de los gases ya que la mayoría de ellos se comportan como un» gas ideal «.
Es importante señalar que las tres leyes de los gases exponen el comportamiento de los gases perfectos, ya que una de las cantidades, ya sea presión, temperatura o volumen, es constante, mientras que las otras dos son variables.
Algunas características que definen los gases ideales son:
- Movimiento desordenado y no interactivo entre moléculas;
- La colisión de moléculas de gas son elásticas;
- Ausencia de fuerzas de atracción o repulsión;
- Tienen masa, baja densidad y volumen insignificante.
Ley de Boyle
La ley de Boyle-Mariotte fue propuesta por el químico y físico irlandés Robert Boyle (1627-1691).
Presenta el transformación isoterma gases ideales, de modo que la temperatura permanece constante, mientras que la presión y el volumen del gas son inversamente proporcionales.
Por tanto, la ecuación que expresa la ley de Boyle es:
Dónde,
PAG: presión de muestra
V: volumen
K: temperatura constante (depende de la naturaleza del gas, la temperatura y la masa)
Ley de Gay-Lussac
LA Ley de Gay-Lussac fue propuesto por el físico y químico francés Joseph Louis Gay-Lussac (1778-1850).
Presenta el transformación isobárica de los gases, es decir, cuando la presión del gas es constante, la temperatura y el volumen son directamente proporcionales.
Esta ley se expresa mediante la siguiente fórmula:
Dónde,
V: volumen de gas
T: temperatura
k: presión constante (isobárica)
Obtenga más información sobre la transformación isobárica.
Charles Law
LA Charles Law fue propuesto por el físico y químico francés Jacques Alexandre Cesar Charles (1746-1823).
Presenta el transformación isométrica o isocórico de los gases perfectos. Es decir, el volumen del gas es constante, mientras que la presión y la temperatura son cantidades directamente proporcionales.
La fórmula que expresa la ley de Charles es:
Dónde,
PAG: presión
T: temperatura
K: constante de volumen (depende de la naturaleza, el volumen y la masa del gas)
Lea también sobre Transformaciones de gas.
Ecuación de Clapeyron
LA Ecuación de Clapeyron fue formulado por el físico-químico francés Benoit Paul Émile Clapeyron (1799-1864). Esta ecuación consiste en la unión de las tres leyes de los gases, en la que relaciona las propiedades de los gases entre: volumen, presión y temperatura absoluta.
Dónde,
PAG: presión
V: volumen
norte: número de lunares
R: constante universal de gases perfectos: 8,31 J / mol.K
T: Temperatura
Ecuación general de gases perfectos
La Ecuación General de Gases Perfectos se usa para gases que tienen masa constante (número de moles) y variación de cualquiera de las cantidades: presión, volumen y temperatura.
Se establece mediante la siguiente expresión:
Dónde,
PAG: presión
V: volumen
T: temperatura
K: constante molar
PAG1: presión inicial
V1: volumen inicial
T1: temperatura inicial
PAGdos: presión final
Vdos: Volumen final
Tdos: temperatura final
vea también: Transformación adiabática