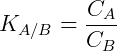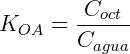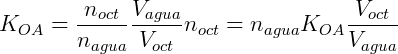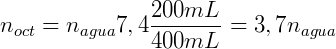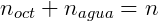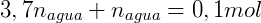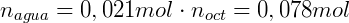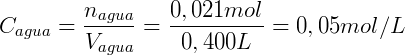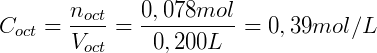LOS ley de partición o distribución, también llamado Ley de partición de Nernst en honor al físico-químico alemán Walther Nernst que estudió el tema, establece una relación de equilibrio entre un soluto disuelto en dos fases inmiscibles.
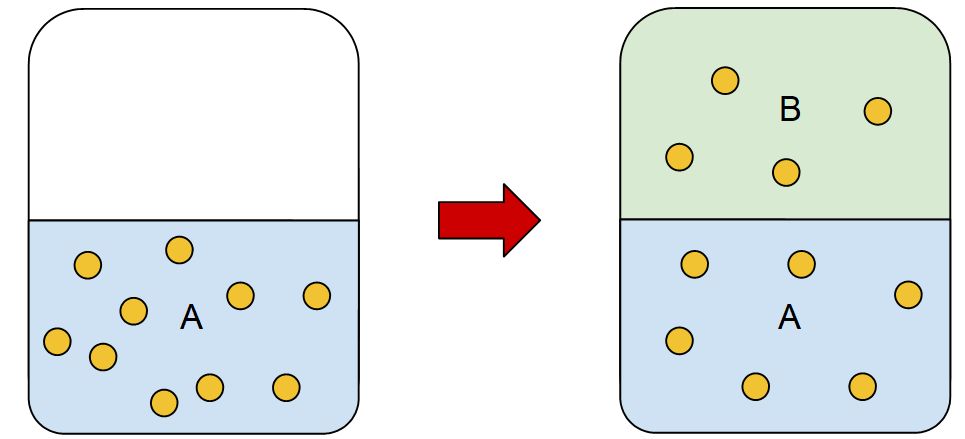
Supongamos que en un líquido A se disuelve cierta cantidad de soluto S, si se pone en contacto una segunda fase B inmiscible con A con esta solución, se llevará a cabo un proceso de extracción, donde el soluto S se trasladará lentamente a la fase B.
La transferencia de materia tiene lugar hasta cierto punto, donde los sistemas se equilibran. Se observa que las concentraciones en las fases A y B se pueden relacionar según la expresión matemática de la ley de partición:
Donde C es la concentración de soluto y K es la distribución o coeficiente de partición. En el ejemplo anterior, cuanto mayor es el coeficiente de reparto, mayor es la concentración del soluto en A.
El coeficiente de reparto depende de la naturaleza de los líquidos y de la afinidad del soluto por ellos, este valor también varía según la temperatura, presión y pH de las soluciones.
Básicamente, hay dos formas de interpretar esta expresión. Desde un punto de vista cinético, entendemos que, en equilibrio, la velocidad con la que se transfiere el soluto de la fase A a la fase B es la misma que en el proceso contrario. Desde un punto de vista termodinámico, decimos que en equilibrio las dos fases tienen el mismo potencial químico.
También son importantes las consideraciones sobre la naturaleza de las sustancias implicadas. Las fases A y B deben ser inmiscibles, por lo que en general este tipo de sistema involucra un líquido polar y un líquido apolar. En este sentido, los solutos no polares, como los hidrocarburos, preferirán disolverse en la fase no polar, mientras que los solutos polares, como las sales, se concentrarán en la fase polar.
Un sistema de partición típico es octanol / agua. Este sistema está ampliamente estudiado y tiene aplicaciones en biología y farmacología. El coeficiente de partición en este caso es:
Suponga que agregamos 0.1 mol de n-butanol en un sistema donde tenemos 200 mL de octanol y 400 mL de agua. Suponiendo que el coeficiente de distribución del n-butanol es de 7,4 podemos calcular la concentración en cada una de las fases. expresando KOA dependiendo de la cantidad de lunares que tengamos:
También sabemos que la suma del número de moles de n-butanol en cada fase debe ser igual al número total de moles:
Finalmente, usamos el volumen de cada fase para calcular la concentración:
Usando la ley de partición de Nernst, pudimos describir este sistema.