LA ley de los gases ideales o gases perfectos Surgió de la combinación de leyes que describen el comportamiento de los sistemas gaseosos. La primera de estas descripciones es la Ley de Boyle, que se puede expresar como:
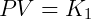
Donde se establece que el producto de la presión y el volumen es una constante k1 eso depende de la temperatura. La segunda expresión importante es la Ley Gay-Lussac, que se describe a continuación:
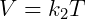
Esta ley dice que, dada una cierta presión, el volumen es proporcional a la temperatura. Finalmente, tenemos la ley de Charles, que dice que la presión y la temperatura son proporcionales, de acuerdo con la siguiente ecuación:
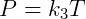
Estas tres expresiones se pueden combinar convenientemente para escribir:
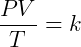
Donde k es una constante. Esta relación indica que la relación presión-volumen producto a temperatura es constante. Esta constante es la misma para todos los gases ideales bajo cualquier condición, pero cambia según la cantidad de materia en el sistema. Sabemos por la ley de Avogadro que:
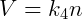
Dónde norte es la cantidad de materia, generalmente medida en moles, de gas en el sistema. Luego podemos reescribir la relación anterior:
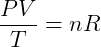
Donde R es una constante universal para gases ideales que es independiente de cualquier condición. De esta forma tenemos la expresión más genérica, y útil para trabajar con este tipo de gas. Esta expresión se conoce como Ecuación de Clapeyron, habiendo sido formulado por Benoit Paul Émile Clapeyron combinando las leyes de los gases previamente conocidas. Por lo general, está escrito:
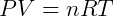
La constante de gas R debe usarse de acuerdo con las unidades de P, V y T. La siguiente tabla muestra algunos valores de la constante para diferentes unidades de presión y volumen.
| Presión (P) | Volumen (V) | Temperatura
| Constante (R) |
|
| Cajero automático | L | K | 0,0820 atm LK-1.mol-1 |
| Sartén | m³ | K | 8.314 Pa.m3.K-1.mol-1 |
| mmHg | L | K | 62,364 mmHg LK-1.mol-1 |
Cuando un gas se somete a cualquier transformación que no implique cambios en la cantidad de materia, podemos formular una expresión relacionando el estado final e inicial del sistema:
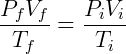
Esta relación es consistente con las leyes de Boyle, Gay-Lussac y Charles.
Es importante señalar que las ecuaciones y leyes descritas hasta ahora son aplicables a los gases ideales. Un gas ideal se idealiza como un conjunto de partículas (moléculas) que se mueven constantemente de manera aleatoria, cumpliendo las siguientes condiciones:
- El volumen ocupado por cada partícula es insignificante en relación con el espacio entre ellas;
- No hay fuerzas interactivas entre las partículas;
- Las partículas interactúan solo a través de colisiones elásticas.
El modelo de gas ideal es muy útil y preciso para muchos gases, los que no están bien descritos por este modelo se denominan gases reales. Sin embargo, existe una variedad de condiciones en las que los gases reales se comportan de manera óptima; en general, estas condiciones implican bajas presiones y grandes volúmenes.
Ejercicios y preguntas vestibulares
Pregunta 01: (PUC-RIO 2009)
0,5 moles de un gas ocupan un volumen V de 0,1 m3 cuando está a una temperatura de 300 K. ¿Cuál es la presión del gas a 300 K? Considere R = 8,3 J / mol K.