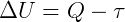Tabla de contenidos
La palabra termodinámica se origina en los términos griegos terma (calor y dynamis (potencia, fuerza), por lo que se define como el campo de la física que estudia el calor en movimiento (o energía térmica en tránsito) y la energía mecánica en movimiento (trabajo). Se trata de fenómenos que involucran los conceptos de calor y temperatura. También estudia los intercambios de calor y trabajo entre un sistema y su entorno externo, las relaciones entre estos intercambios y las propiedades del sistema.
Al hablar de termodinámica, es necesario destacar las características de los estudios. microscópico y macroscópico eso se puede hacer.
Estudiando el leyes de la termodinámica No es recomendable realizar un estudio microscópico, ya que involucraría un número gigantesco de partículas (del orden de 1024), átomos o moléculas, moviéndose de forma desordenada, chocando entre sí y con la pared del recipiente que los rodea.
La descripción macroscópica, por otro lado, involucra pocos parámetros y es fácil de calcular: volumen, temperatura y presión. El estudio de las leyes de la termodinámica, por lo tanto, hace una descripción macroscópica, siempre involucrando un gran número de partículas (no tiene sentido con unas pocas, como 2 o 3), para promediar los muchos movimientos que tienen lugar en el microscopio. mundo, teniendo así un carácter estadístico.
También sabemos que las leyes de la termodinámica surgieron como leyes empíricas, con características fenomenológicas, y sólo más tarde apareció la mecánica estadística y la termodinámica, ofreciendo un estudio microscópico de las leyes.
Primera ley de la termodinámica
LOS Primera ley de la termodinámica se ocupa del principio de conservación de la energía, de forma cuantitativa. En un proceso termodinámico, la energía total se conserva, por lo que la variación de la energía interna (ΔU) de un sistema es la diferencia entre el calor (Q) intercambiado con el medio y el trabajo (τ) realizado por el sistema en la vecindad. , a través de una fuerza:
En resumen, un sistema nunca puede crear o destruir energía, solo transformarla.
Segunda ley de la termodinámica
LOS Segunda ley de la termodinámica realiza un análisis cualitativo del proceso termodinámico.
Tiene dos declaraciones, la de Clausius, concluyendo que:
es imposible para un sistema que solo transfiere calor de una fuente fría a una fuente caliente, o solo es posible que el calor pase de una fuente fría a una fuente caliente que suministre energía al sistema.
Y la declaración de Kelvin, que en resumen dice:
en una transformación cíclica es imposible transformar toda la energía térmica (calor) recibida de una sola fuente caliente en energía mecánica (trabajo).
Es decir, el calor nunca fluirá de un cuerpo frío a uno caliente, a menos que haya trabajo. Y no todo el calor se convertirá en trabajo, una parte se pierde, en un motor térmico que funciona en ciclos.
La Segunda Ley también se define al señalar que la entropía solo puede cambiar en una dirección.
La entropía es una propiedad del universo que mide el nivel de irreversibilidad (desorganización) de un sistema. Cuanto mayor es la entropía, mayor es la irreversibilidad. En el cero absoluto no habría desorganización.
La segunda ley demuestra que la entropía del universo siempre aumenta y que nunca se puede alcanzar el cero absoluto.
Tercera ley de la termodinámica
LOS Tercera ley de la termodinámica define que, en una escala absoluta de temperatura, cuyo mínimo es el cero absoluto, en el mínimo de esta escala, la entropía de todas las sustancias es la misma.
Ley cero de la termodinámica
LOS Ley cero de la termodinámica fue introducido después de las primeras leyes. Esto se debió a que se completó después de las primeras leyes, pero debido a que era fundamental para estas, se llamó Ley Cero, para llegar antes que las demás.
Esta Ley define que, si hay dos sistemas que están en equilibrio térmico con un tercer sistema, entonces estos dos sistemas estarán en equilibrio térmico entre sí. Esto es lo que pasa con el termómetro, por ejemplo. Para saber si dos objetos tienen la misma temperatura, mida ambos con un termómetro. Teniendo la misma marca, estarán en equilibrio térmico entre sí.
Recordando que el equilibrio térmico es la igualdad de temperaturas.
Referencia bibliográfica:
NUSSENZVEIG, Moysés, Curso de Física Básica: Fluidos, Oscilaciones y Ondas, Calor – Vol. 2, 4 ed. – Edgard Blücher, 2002.