Tabla de contenidos
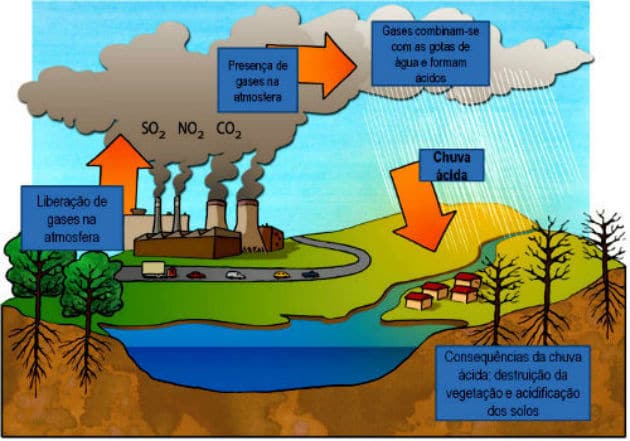
La lluvia ácida es una precipitación con presencia de ácido sulfúrico, ácido nítrico y nitroso, resultado de reacciones químicas que ocurren en la atmósfera.
Todas las lluvias son ácidas, incluso en ambientes sin contaminación. Sin embargo, la lluvia se convierte en un problema ambiental cuando su pH está por debajo de 4.5.
Son el resultado de la cantidad exagerada de productos de la quema de combustibles fósiles que se liberan a la atmósfera como resultado de las actividades humanas.
¿Cómo se forma la lluvia ácida?
Dióxido de carbono (COdos) en la atmósfera ya hace que la lluvia sea ligeramente ácida, incluso en condiciones naturales. El pH natural del agua es 7 y cuando está en equilibrio con COdos atmosférico es 5,6, poco ácido.
Óxidos de azufre (SOdos es sólo3) y nitrógeno (NdosO, NO y NOdos) son los principales componentes de la lluvia ácida. Estos compuestos se liberan a la atmósfera mediante la quema de combustibles fósiles. Al reaccionar con las gotas de agua de la atmósfera, forman ácido sulfúrico (HdosSOLO4) y ácido nítrico (HNO3). Juntos, estos dos ácidos aumentan la acidez del agua de lluvia.
Vea las reacciones químicas de formación de estos ácidos:
1. Formación de ácido sulfúrico:
2. Formación de ácido nítrico y ácido nitroso:
En presencia de estos ácidos, el pH del agua de lluvia puede alcanzar entre 4 y 2, valores extremadamente ácidos.
Obtenga más información, lea también:
Causas
Las actividades humanas son las principales responsables de este fenómeno de lluvia ácida. Como hemos visto, la liberación de gases por el uso de combustibles fósiles es el principal responsable de la formación de lluvia ácida.
Así, son el resultado del uso de combustibles fósiles en el transporte, en plantas termoeléctricas, en industrias y otras formas de combustión. También pueden formarse por causas naturales, como la liberación de gases durante la erupción de un volcán.
Consecuencias
Los países industrializados son los más afectados por la lluvia ácida. Sin embargo, las corrientes de aire pueden transportar contaminantes a lugares distantes.
Esto ocurrió en los lagos escandinavos, que se acidificaron por las lluvias como resultado de las actividades industriales en Alemania, Francia y Reino Unido.
Para la naturaleza, las consecuencias de la lluvia ácida son la destrucción de la cubierta vegetal, la acidificación de suelos y aguas de ríos y lagos.
Un ejemplo de las consecuencias de la lluvia ácida se observó en Brasil. El municipio costero de Cubatão, en São Paulo, tiene una gran concentración de industrias y la lluvia ácida ha destruido la vegetación en la ladera de la Serra do Mar, exponiendo el suelo a la erosión.
Cuando la acidificación llega al suelo y aguas de ríos y lagos, los seres vivos que habitan estos lugares se ven afectados. El agua y el suelo se vuelven inadecuados para albergar algunos organismos, provocando su muerte.
La lluvia ácida también puede provocar la corrosión de mármoles y calizas y la oxidación de metales en monumentos históricos, como edificios y estatuas.

Conozca otro fenómeno ambiental causado por el exceso de gases contaminantes en la atmósfera, el efecto invernadero.



