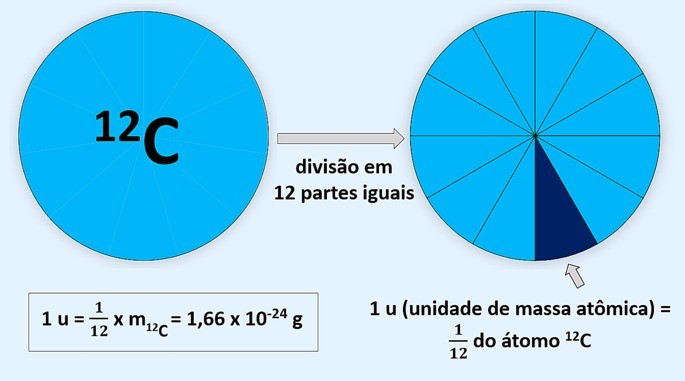
LA masa atomica es la forma estándar de medir la masa de átomos, expresada en unidades de masa atómica (u).
Los químicos decidieron tomar el carbono como base, por lo que se dice que la masa atómica es relativa. Se determinó que una unidad de masa atómica equivale a 1,66 x 10-24 g, lo mismo que 1/12 de la masa de carbono-12.
Las masas de los átomos se comparan con este estándar de 1u, lo que significa que la masa atómica indica cuántas veces un átomo pesa más de 1/12 del carbono.
Veamos algunos ejemplos de masa atómica:
- Carbono (C) – 12,011
- Oxígeno (O) – 15,999
- Cloro (Cl) – 35.453
- Nitrógeno (N) – 14,007
- Potasio (K) – 39,098
- Helio (He) – 4,003
¿Cómo calcular la masa atómica?
En la naturaleza podemos encontrar elementos químicos con el mismo número atómico, pero con diferentes masas atómicas. Estos elementos se denominan isótopos.
La masa atómica de los elementos químicos resulta del promedio ponderado de los isótopos.
Tomemos, por ejemplo, dos isótopos de cualquier elemento químico: 22X y 36X, donde 22 y 36 son sus masas.
Imaginemos también que la abundancia de estos isótopos en la naturaleza es del 40% y 60%, respectivamente.
A partir de estos datos, es posible calcular la masa atómica. Primero, la masa se multiplica por la abundancia de cada uno de los isótopos. Luego suma esos resultados y divide por 100.
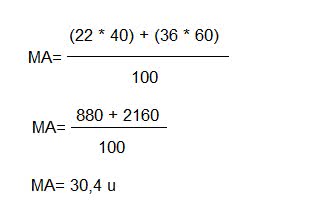
Por tanto, la masa atómica de un elemento X, cuyas masas de isótopos son 22 y 36 y abundancia del 40% y 60%, respectivamente, es 30,4 u.
Masa molecular y masa molar
La masa molecular corresponde a la masa de una molécula. Para calcularlo es necesario sumar las masas atómicas de los átomos de los elementos químicos que componen la sustancia.
Por ejemplo, agua (HdosO) está formado por 2 átomos de hidrógeno y 1 átomo de oxígeno. Para determinar la masa molecular del agua, consultamos la tabla periódica para encontrar la masa atómica de cada elemento y multiplicarla por el número de átomos.
H: 2 x 1 u = 2 u
O: 1 x 16 u = 16 u
HdosO = 2 u + 16 u = 18 u
Por tanto, una molécula de agua tiene una masa de 18 u.
LA masa molar, a su vez, es la masa expresada en gramos por mol. El mol es una unidad que se usa como estándar para medir la cantidad de materia. Esta unidad tiene un valor absoluto de 6.02 x 1023 átomos, iones o moléculas de una sustancia.
La masa molecular y la masa molar tienen el mismo valor numérico, pero se presentan en unidades diferentes. Por tanto, la molécula de agua tiene una masa molecular de 18 u y una masa molar de 18 g / mol.
Obtenga más información en Número de mol y masa molar.
Masa atómica en la tabla periódica
Como la masa atómica depende de la masa de todos los isótopos de un elemento químico, para evitar que siempre se hagan cálculos, la tabla periódica presenta esta información.
Vea el ejemplo de la plancha:
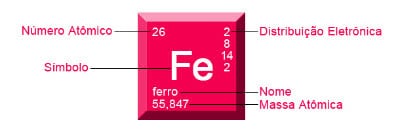
La masa atómica es el valor que aparece justo debajo de los nombres de cada elemento en la tabla periódica.
La tabla periódica está organizada en orden ascendente de número atómico. Generalmente, la masa atómica aumenta a medida que aumenta el número atómico. De los 118 elementos químicos de la tabla periódica, solo 4 elementos consecutivos difieren de esta generalidad. Ellos son: argón, cobalto, telurio y torio.
Ejercicios de masa atómica
Pregunta 1
(UFPE) Hay dos isótopos de rubidio que se encuentran en la naturaleza: 85Rb, que tiene una masa igual a 84,91, y 87Rb, cuya masa es 86,92. El peso atómico del rubidio es 85,47. ¿Cuál es el porcentaje de 87Rb?
a) 72,1%
b) 20,1%
c) 56,0%
d) 27,9%
e) 86,9%
Pregunta 2
(Cesgranrio-RJ) Un elemento X tiene una masa atómica de 63,5 y tiene isótopos 63X y sesenta y cincoX. La abundancia del isótopo 63 en el elemento X es:
a) 25%
b) 63%
c) 65%
d) 75%
e) 80%
Nota: Considere los números de masa 63 y 65 como las masas atómicas de estos isótopos.
Pregunta 3
(UFRGS_RS) El elemento cloro tiene una masa atómica igual a 35.453 u. Esta información significa que:
a) el átomo de cloro tiene una masa 35.453 veces mayor que la masa del átomo de hidrógeno.
b) la masa de un átomo de cloro es 35 453 veces mayor que la masa del isótopo 12 del carbono.
c) la relación entre las masas de cloro y átomos de carbono es 35,453 ÷ 12.
d) cualquier átomo de cloro tiene una masa 35,453 veces mayor que 1/12 del isótopo de carbono 12.
e) el promedio ponderado de las masas de isótopos de cloro es 35 453 veces mayor que 1/12 de la masa del isótopo 12 de carbono.
Pregunta 4
(FEI-SP) Si un átomo tiene una masa atómica igual a 60 u, ¿será válida la relación entre la masa de ese átomo y la masa del átomo de carbono 12?
a 1
b) 2
c) 3
d) 4
e) 5
Pregunta 5
(UFSCar-SP) El elemento magnesio, número atómico 12, se encuentra en la naturaleza como una mezcla de tres isótopos. Las masas atómicas de estos isótopos, expresadas en unidades de masa atómica (u), y sus respectivas abundancias en un lote dado del elemento, se dan en la siguiente tabla.
| Número de masa de isótopos | Masa atómica (u) | % abundancia |
|---|---|---|
| 24 | 23,98504 | 10 |
| 25 | 24,98584 | 10 |
| 26 | 25,98259 | 80 |
La masa atómica de este lote, en u, es igual a:
a) 23,98504, exactamente.
b) 24,98584, exactamente.
c) 25,98259, exactamente.
d) un valor entre 23,98504 y 24,98584.
e) un valor entre 24,98584 y 25,98259.
Verifique los problemas vestibulares con resolución comentada en: Ejercicios de la tabla periódica.