La ciencia de los átomos a principios del siglo XX sufrió una serie de cambios profundos en sus modelos explicativos. Rutherford propuso un modelo que consideraba que el átomo tenía un núcleo denso y una electrosfera gigantesca, donde los electrones orbitaban.
Inicialmente, este nuevo modelo explicaba satisfactoriamente el reflejo de partículas alfa, aunque entraba en conflicto con principios intrínsecos a la física de partículas. En un momento, los científicos se preguntaron cómo la electrosfera mantendría a los electrones en órbita y por qué, después de un tiempo, estos electrones no perderían energía, cayendo así en el núcleo del átomo.
Los estudios del espectro electromagnético, llevados a cabo por Robert Bünsen a mediados del siglo XIX, indicaron una posible elucidación de estos problemas. Bünsen y su colaborador, Gustav Kirchhoff, estudiaron los espectros de emisión de varios gases y observaron que, además de no repetir el patrón de líneas espectrales, estas mismas líneas estaban separadas por espacios vacíos.
Este fenómeno, inexplicable para el modelo de Rutherford, ya que no había una convicción plena de cómo se comportaba la electrosfera, llamó la atención de Niels Bohr (* 1885 – † 1962). Según Bohr, la teoría propuesta por Max Planck para el comportamiento de la luz (teoría cuántica / cuantificación de energía) podría resolver las dudas que se cernían sobre el modelo atómico de Rutherford, además de explicar los espectros lineales de emisión atómica observados por Bünsen.
Bohr afirmó que las órbitas presentes en la electrosfera estarían dotadas de un nivel mínimo de energía, responsable de mantener los electrones en sus órbitas, evitando así que pierdan energía y caigan al núcleo. Estando estos electrones en órbitas circulares (relativas al núcleo), mantendrían el nivel mínimo de energía necesario para este movimiento, llamándose a este nivel mínimo de energía el estado fundamental del átomo.
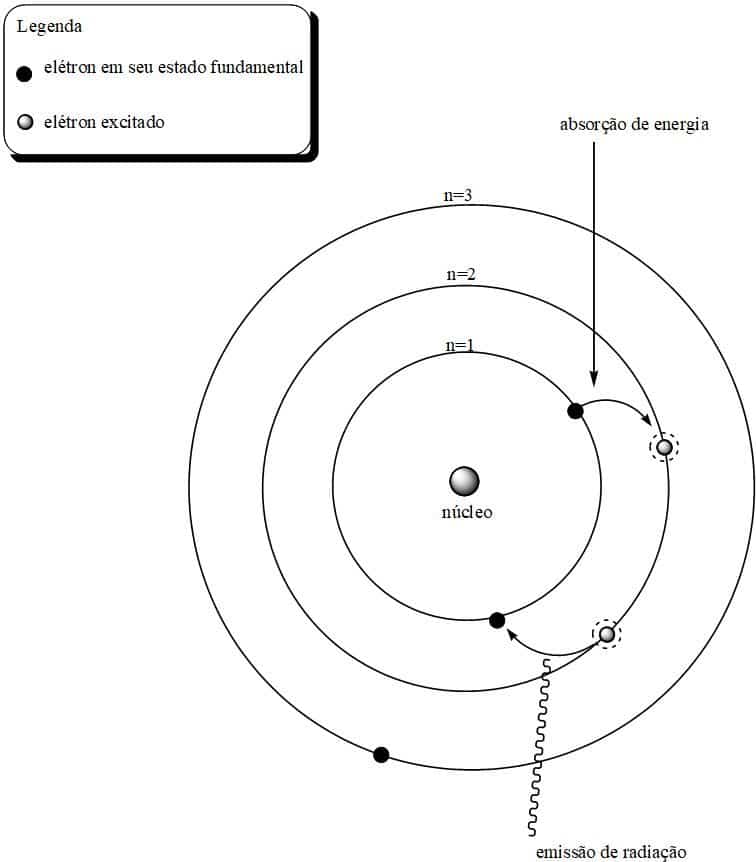
Cualquier perturbación en este nivel (suministro de energía térmica o eléctrica, por ejemplo) provocaría un aumento en la energía potencial del electrón, haciendo que el electrón saltara de su nivel actual al siguiente nivel de energía. Y como este nivel de energía más alto sería «extraño» para el electrón, volvería a su nivel original (energía más baja), liberando radiación en el proceso. La siguiente figura ejemplifica el proceso postulado por Bohr.
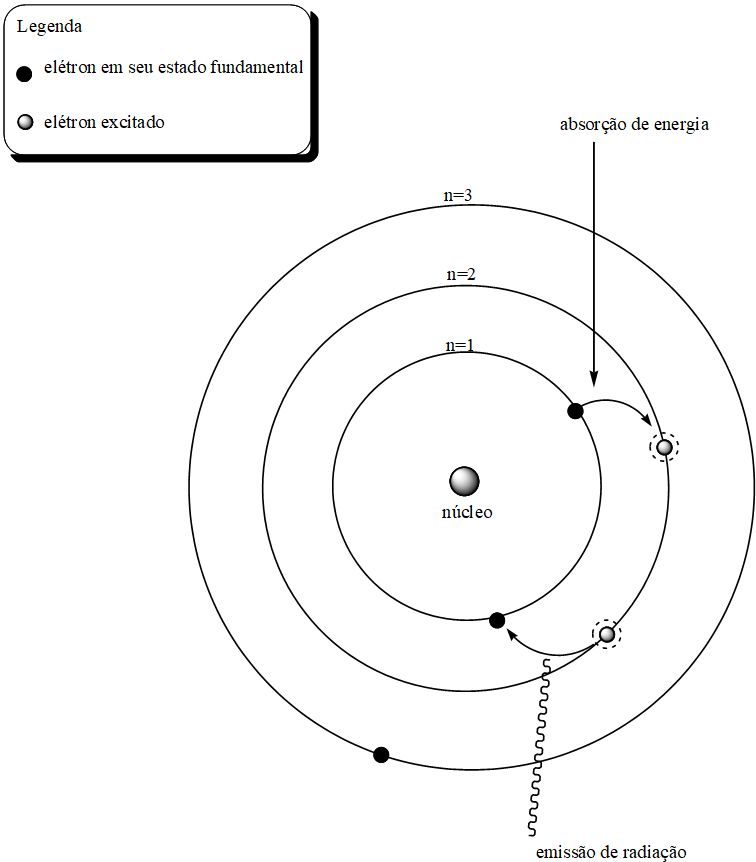
Modelo atómico de Bohr y liberación de luz a través de espectros lineales.
La proposición de Bohr pudo explicar el fenómeno de los espectros y respondió a la pregunta de por qué el átomo permanece estable. La mecánica de la órbita también propuso que los niveles más alejados del núcleo tienen valores de energía más altos, hipotéticamente tendiendo al infinito.
O Modelo atómico de Bohr También previó la existencia de órbitas cuya permanencia electrónica no sería posible, llamándolas órbitas prohibidas (presentes entre los niveles de energía conocidos). En tales órbitas los electrones no podrían permanecer y terminarían emitiendo un exceso de energía al pasar de un nivel a otro. Los niveles “permitidos” no emitirían energía y por lo tanto permanecerían estables.
La propuesta del modelo de Niels Bohr consideró siete niveles o capas de energía (K, L, M, N, O, P, Q) donde la capa K = n1; L = n2; M = n3 …; donde teóricamente, los electrones estarían orbitando en sus trayectorias esféricas.
El modelo de Bohr tenía limitaciones cuando se trataba de elementos distintos al hidrógeno, ya que no podía explicar el espectro de rayas, formado por elementos con más electrones, donde Sommerfeld propone alteraciones al modelo atómico de Bohr.
Lea también:
Referencias:
LISBOA, JCF Química, 1er año: bachillerato. 1ª Ed. – São Paulo: Ediciones SM, 2010. (Colección Ser protagonista). por. 123 – 127.
FELTRE, R; YOSHINAGA, S. Atomística – 1ª Ed. – São Paulo: Moderna, 1970. p. 126-138.
FELTRE, R. Química General – 5ª Ed. – São Paulo: Moderna, 2000. p.98 – 106.