Tabla de contenidos
El monóxido de carbono es un gas incoloro, inodoro, inflamable y tóxico.
Su fórmula molecular es CO. Consiste en una molécula de carbono y oxígeno.
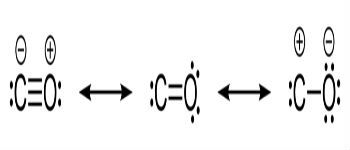
Fórmulas estructurales de monóxido de carbono y enlaces químicos entre carbono y oxígeno.
Se origina de dos formas:
- Fuentes emisoras naturales: actividad de volcanes, gas natural y descargas eléctricas.
- Actividades humanas: resultado de la combustión incompleta de combustibles fósiles. Los incendios producen toneladas de CO, siendo una de las principales actividades que liberan CO a la atmósfera.
Características
El monóxido de carbono pertenece al grupo de los óxidos. Se clasifica como óxido neutro, los formados por un metal más oxígeno. Además, no reacciona con agua, ácidos y bases.
Se utiliza como agente reductor, elimina el oxígeno de un compuesto y produce dióxido de carbono (COdos). Por tanto, su uso en el procesamiento de minerales, como el hierro, es muy común. Asimismo, en la producción de sustancias orgánicas, como ácido acético, plásticos, metanol, entre otros.
Cuando reacciona con el oxígeno del aire, produce dióxido de carbono. Según la siguiente reacción química: 2 CO + Odos → 2 COdos
En aguas superficiales, la alta concentración de monóxido de carbono sirve como fuente de energía para los microorganismos.
El monóxido de carbono es uno de los gases de efecto invernadero. Su concentración en la atmósfera contribuye a una mayor retención de calor. Por tanto, se considera un gas contaminante.
Intoxicación
El CO tiene una gran afinidad por la hemoglobina. Debido a que es tóxico, su inhalación tiene efectos sobre la salud humana e incluso puede provocar la muerte.
Debido a que el CO no tiene olor, es posible que se inhale sin que se note. Por eso, en algunos casos, la persona tarda en notar la intoxicación.
Cuando se inhala en baja concentración, causa migrañas, pensamiento lento, irritación de los ojos y pérdida de la capacidad manual. En concentraciones elevadas puede provocar convulsiones, pérdida del conocimiento e incluso la muerte por asfixia.
Pero, ¿cómo ocurre la intoxicación?
La hemoglobina se une naturalmente a Odos y lo transporta a los tejidos del cuerpo. Sin embargo, la afinidad entre el CO y la hemoglobina es mucho mayor, unas 250 veces más que con el Odos.
En presencia de CO, la hemoglobina se une a él, impidiendo el transporte de oxígeno a las células. La combinación de CO y hemoglobina da lugar a carboxihemoglobina.
Las principales causas de intoxicación por CO ocurren en las siguientes situaciones:
- Motores de automóviles que funcionan en interiores;
- Quema de gas natural en calentadores ineficientes;
- Escape del gas de la cocina o del horno de leña en lugares mal ventilados.
En los países de clima frío, las casas tienden a permanecer cerradas durante más tiempo y utilizan sistemas de calefacción. Para evitar accidentes por gas, los detectores de CO se utilizan cada vez más.
Amplia información:
Tiene un punto de fusión de -205.07 ° C, y un punto de ebullición de -191.55 ° C, densidad de 1.25 kg · m-³ (0 ° C), siendo parcialmente soluble en agua (30 mg L-1), y en algunos solventes orgánicos, como cloroformo, etanol, ácido acético, entre otros. El monóxido de carbono es incompatible con el cloro, óxido nitroso, acetileno y flúor y produce carbonilos tóxicos e inflamables al reaccionar con metales. Es un gas incoloro, inodoro y ligeramente inflamable, inodoro y bastante tóxico, que si se inhala en pequeñas concentraciones provoca dolor de cabeza, mareos, irritación ocular, alteración de la visión y disminución de la destreza manual. En concentraciones moderadas provoca problemas en el sistema nervioso y cardiovascular, en concentraciones elevadas puede provocar la muerte por asfixia.
La molécula de CO forma la molécula de carboxihemoglobina (HbC) al hacer un enlace químico muy estable con la hemoglobina, lo que hace imposible el transporte de oxígeno en el proceso respiratorio. Su afinidad por la hemoglobina es más de 200 veces mayor que la del oxígeno. Además, la molécula de CO inhibe la enzima citocromo C oxidasa mitocondrial, y tiene efectos inflamatorios, además de incrementar el estrés oxidativo perivascular, por lo que su inhalación independientemente del nivel de concentración es bastante perjudicial para el organismo. Además, en presencia de luz o calor reacciona con el cloro (Cldos), formando fosgeno (COCldos), un gas extremadamente tóxico que a menudo se forma cuando los plásticos y otros materiales sintéticos se queman en un lugar con baja concentración de O.dos.
Puede ser emitido por fuentes naturales o antropogénicas. Las emisiones naturales pueden ser: actividad volcánica, descargas eléctricas y emisiones de gas natural.
Las emisiones antropogénicas, en cambio, están relacionadas con la quema incompleta, en ambientes con baja concentración de oxígeno o altas temperaturas, de carbón mineral, gas natural, derivados del petróleo, combustibles, solventes, madera. También puede ser producto de la oxidación fotoquímica de varios compuestos presentes en la atmósfera, los denominados compuestos orgánicos volátiles (COV), o en cuerpos de agua. Entre todas las fuentes citadas, las concentraciones más altas de CO se liberan por la quema de combustibles fósiles y los incendios forestales. El CO está en la lista del Consejo Nacional del Ambiente (CONAMA) como uno de los parámetros evaluados para el estándar de calidad del aire (PQAr), es considerado un contaminante y responsable del efecto invernadero, ya que contribuye a una mayor retención de calor.
En cuanto a sus aplicaciones, durante la Segunda Guerra Mundial, el CO se utilizó en campos de concentración, más concretamente en cámaras de gas, provocando la muerte de miles de personas. Actualmente, afortunadamente, el uso de CO tiene otros fines. Como agente reductor, es responsable de producir COdos, ya que elimina el oxígeno de varios compuestos en los procesos industriales para la producción de varios metales, como el hierro y el níquel, de sus minerales e hidrógeno del agua. Además, se aplica a la síntesis de ácido acético, metanol e hidrocarburos.