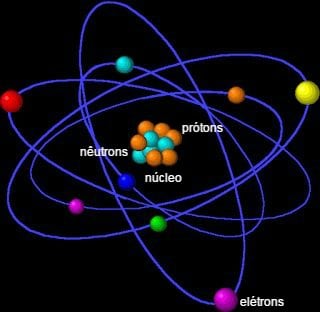
El neutrón (n) es una pequeña partícula que forma el núcleo del átomo. No tiene carga y está formado por partículas aún más pequeñas, que se denominan quarks. El neutrón, o neutrón (en portugués europeo), está formado por dos quarks abajo y un quark arriba.
Junto con los protones (p+), que tienen una carga positiva, los neutrones forman el centro del átomo, su núcleo. Esto simplemente no sucede con el hidrógeno, cuyo núcleo está formado por un solo protón.
Debido a que forman el núcleo del átomo, los neutrones y protones se denominan nucleones. Es la carga positiva de uno y la carga neutra del otro lo que proporciona estabilidad atómica.
Así, la división del núcleo del átomo genera inestabilidad y hace que se parta en dos. Da origen a una reacción en cadena denominada Fisión Nuclear, un proceso que se utiliza en el funcionamiento de bombas nucleares.
Electrones (y–), cuyas cargas son negativas, están ubicadas en la electrosfera, fuera del átomo y tienen una masa casi insignificante.
¿Cómo calcular?
LA suma en neutrones (n) y protón (p +), que es bastante similar, da como resultado el número de masa atómica (A), es decir:
LA = PAG+ + norte
De ello se deduce que el número másico (A) menos el número atómico (Z) es equivalente al número en neutrones presente en un átomo, lo que significa:
norte = LA – Z
Eso es porque la cantidad de protones determina el número atómico.
Los elementos que tienen el mismo número de neutrones se denominan isotónico. Los isotonos tienen un número de masa y un número atómico diferentes.
Obtenga más información en Isótopos, Isobaras e Isotonos.
Los neutrones pueden descomponerse en protones y electrones. Esto se deriva de la decaer Beta (β), lo que hace que el neutrón se desintegre. La emisión beta reduce el neutrón y da lugar a un protón.
Descubrimiento del neutrón
El neutrón fue descubierto en 1932. La existencia de esta partícula ya había sido sugerida por Ernest Rutherford (1871-19374) en la década de 1920, pero fue el científico inglés James Chadwick (1891-1974) quien lo demostró cuando estudiaba la radiactividad.
Historia:
La constitución de la materia era ya una cuestión a la que había que responder desde los tiempos de la antigua Grecia con los grandes filósofos y pensadores de la época. El término materia se entendía como todo aquello que presentaba masa y ocupaba espacio. Entonces, aunque filosóficamente y de manera abstracta, ya existía la idea de que la materia estaba formada por pequeñas partes que se llamaban átomos.
La palabra átomo tiene origen griego y significa indivisible. En ese momento se creía que el átomo era la parte más pequeña que constituía la materia. En otras palabras, la materia podría dividirse innumerables veces en su parte más pequeña, llamada átomo, que sería indivisible.
Durante muchos años esta idea fue aceptada como una verdad absoluta. Con el tiempo y con la evolución de la ciencia se desarrollaron varios modelos de átomos, como los modelos atómicos de Dalton y Thomson, que contribuyeron positivamente al modelo más aceptado en la actualidad.
Modelo de Dalton y modelo de Thomson
En el modelo de Dalton, el átomo estaba compuesto por una esfera diminuta y totalmente masiva que era impenetrable, no podía ser destruida ni dividida, y el átomo también tenía carga cero. El modelo atómico de Dalton también se conoce como bola de billar. En el modelo de Thomson, el átomo se describió como una esfera cargada positivamente. Esta esfera tenía una especie de relleno. Luego se descubrió la existencia de partículas con cargas negativas que se denominaron electrones.
El modelo atómico de Thomson también se conoce como budín de pasas. Luego, el físico Rutherford llevó a cabo una serie de experimentos bombardeando una hoja de oro muy delgada con partículas a alta velocidad, concluyendo que las partículas la atravesaban. Estos resultados rompieron totalmente con el pensamiento griego inicial de que el átomo sería indivisible e impenetrable. Rutherford llegó a la conclusión de que el átomo constaba en gran parte de espacios vacíos y luego desarrolló el modelo atómico planetario.
En el modelo atómico planetario, el átomo constaba de un núcleo positivo en el centro y electrones negativos que lo orbitaban. La órbita de los electrones se conoció como electrosfera. Más tarde, la teoría del átomo como planetario fue perfeccionada por el físico Niels Bohr. Bohr incluyó el modelo atómico en la teoría cuántica y pudo explicar cómo los diferentes niveles de energía de la electrosfera impedían que los electrones chocaran con el núcleo porque sus cargas eran opuestas. Entonces, el propio Rutherford propuso el modelo en el que incluso el núcleo estaría compuesto por partes más pequeñas con cargas positivas. Estas partículas se conocieron como protones. El modelo atómico se conocía entonces como modelo de Rutherford-Bohr y actualmente es el modelo más aceptado. Con la evolución de la ciencia y los modelos atómicos, ya se sabe que a pesar de que el átomo es una parte ínfima de la materia, está formado por otras partículas llamadas subatómicas.
Incluso con el descubrimiento del protón, todavía había dudas, si además de ellos, había otras partículas en los núcleos de los átomos y cómo deberían comportarse estas partículas. Luego, un estudiante de Rutherford llamado J. Chadwick obtuvo evidencia de la existencia de otra partícula subatómica con carga cero con 0.1% más masa que el protón y que fue nombrada sugestivamente como neutrón. Este descubrimiento se produjo mediante el estudio de la radiactividad. También se descubrió que la masa atómica de un elemento dado es simplemente la suma del número de protones y el número de neutrones.
Uso de los neutrones
Losneutrones tienen un uso fundamental en el campo tecnológico, como en las bombas atómicas y en los reactores nucleares utilizados en la creación de energía nuclear. La fisión nuclear es el proceso físico detrás de ambos ejemplos. En la fisión nuclear, el núcleo de un átomo pesado considerado inestable se divide en dos núcleos más pequeños que el inicial. En este proceso, hay una alta liberación de energía y tiene una baja probabilidad de ocurrencia natural, pero puede ser inducida por bombardeo de neutrones.
Durante el bombardeo se liberan nuevos neutrones que pueden acabar chocando con los nuevos núcleos, originando varias fisiones sucesivas. Las fisiones sucesivas se conocen como reacción en cadena. La suma de las masas de los núcleos más pequeños es aproximadamente igual a la masa del átomo original.
Este déficit de masa se compensa con la liberación de energía, es decir, la fisión de un átomo inestable da como resultado dos átomos más una enorme emisión de energía. Este proceso se considera una forma de transmutación nuclear. En términos de la relatividad de Einstein, esto significa que la energía se conserva, ya que en su teoría la masa se trata como una forma de energía. La ecuación que relaciona estas cantidades es la famosa E = mcdos.