Después del científico inglés Rutherford al proponer su modelo para el átomo en el que las partículas negativas orbitaban el núcleo de las partículas positivas en órbitas circulares, surgió una contradicción en cuanto a la trayectoria de los electrones y la energía que poseían.
Sabiendo que los electrones tenían aceleración en su órbita circular, debido a la fuerza centrípeta, debían emitir constantemente ondas electromagnéticas, según la teoría clásica de Maxwell, con una consecuente disminución de su energía que se perdía con las emisiones, para que esto ocurriera era necesario que el electrón para disminuir su velocidad y también el radio de su órbita, es decir, describir una trayectoria en espiral del electrón hacia el núcleo, alcanzándolo, en un colapso atómico, lo cual sería absurdo, porque entonces todos los átomos serían inestables.
Fue con Niels Bohr la introducción de un nuevo concepto para explicar lo que realmente debería suceder, la explicación no es más que que hay niveles de energía (o niveles electronicos). Bohr fundó ciertas proposiciones, basadas en la teoría de la mecánica cuántica de Planck, rompiendo con parte de la física clásica, que se conoció como Postulados de Bohr, brevemente:
– Los electrones se mueven espontáneamente en órbitas estables sin irradiar energía. Estas órbitas corresponden a aquellas en las que el momento angular del electrón alrededor del núcleo es igual a múltiplos enteros de «h / 2π», siendo «h» la constante de Planck.
– La energía absorbida o emitida por el electrón al saltar de una órbita a otra está cuantificada y dada por la expresión: Ef – Ei = hf, donde «Ei» y «Ef» son las energías del electrón antes y después, «f» la la frecuencia e «h» es la constante de Planck.
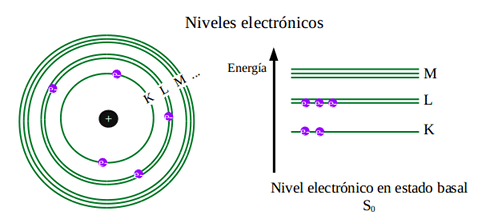
Los niveles descritos por Bohr son los niveles electrónicos, representados simplemente por «n» o número cuántico, con la observación experimental del espectro discontinuo de luz que emiten los electrones al saltar de una órbita a otra, concluyó la cuantificación de la energía en cada órbita estacionaria.
Los niveles de energía también ganaron una representación de letras: K: 1, L: 2, M: 3, N: 4, O: 5, P: 6 y Q: 7.
Hoy en día, también se sabe que cada nivel contiene subniveles de energía discretos.
Aunque el modelo de Bohr falla para átomos más complicados, la teoría aceptada hoy por Louis De Broglie, basada en la mecánica ondulatoria, todavía se basa en el concepto de niveles electrónicos.