Tabla de contenidos
Los números cuánticos son cuatro: principal (n), secundario (l), magnético (mo ml) y espín (so mS). Tienen la función de localizar electrones, por lo que no hay electrones que tengan los mismos cuatro números cuánticos.
La naturaleza humana nos urge a justificar toda la información para producir conocimiento humano, ilustrado por la cultura (cultura ‘científica’, cultura conductual, etc.). En el campo de la química, especialmente la atomística, varios científicos intentaron proponer modelos explicativos que justificaran los fenómenos observados en la naturaleza. De esta necesidad surge la teoría de los modelos atómicos, creada, volcada y mejorada a partir de la observación de las «leyes naturales» que rigen el universo visible e invisible.
[ align=»aligncenter» width=»769″]
De estas observaciones surgieron varios modelos atómicos, como Dalton, Thomson, Rutherford, etc. Como no es la intención discutir la evolución de los modelos atómicos en este momento, es suficiente para nosotros reconocer que la números cuánticos son conceptos fundamentales evidenciados por el modelo atómico de Schrödinger. La teoría del modelo atómico de Schrödinger está actualmente aceptada y asume la existencia de números cuánticos conocidos (s, p, d, f) y también teóricos (g, h, i …), basados en cuatro características de la Mecánica Cuántica.
Estas cuatro características se denominaron números cuánticos, que se pueden enumerar:
- número cuántico principal (n)
- Número cuántico secundario o azimutal (l)
- Número cuántico magnético (mo ml)
- Número cuántico de espín cuántico (S oms)
número cuántico principal
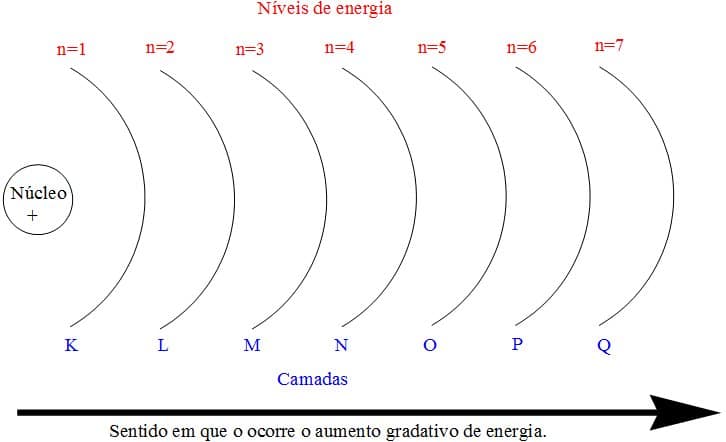
El número cuántico principal (n) define el nivel de energía o capa que tienen los electrones, definiendo también la distancia del orbital al núcleo y el tamaño del orbital ocupado por el electrón. Este concepto es similar al concepto de capa adoptado por Niels Böhr.
Las capas electrónicas K, L, M, N, O, P y Q representan, respectivamente, los siguientes números cuánticos principales 1, 2, 3, 4, 5, 6 y 7:
K = 1, L = 2, M = 3, N = 4, O = 5, P = 6, Q = 7
número cuántico secundario
El número cuántico secundario (l) es característico para definir el subnivel de energía de un electrón. Los valores de l comienzan de cero a infinito, pero actualmente se conocen pocos subniveles (s, p, d, f). Los subniveles de energía se definen en Mecánica Cuántica por: l = n-1; con los subniveles enumerados en la siguiente tabla:
| Nivel de energía (n) | valor de l | subniveles | Subniveles teóricos | subniveles conocidos | Número máximo de electrones * |
| 1 | 0 | 1 | s | s | dos |
| dos | 0,1 | dos | y, p | y, p | 2 + 6 = 8 |
| 3 | 0, 1, 2 | 3 | y p d | y p d | 2 + 6 + 10 = 18 |
| 4 | 0, 1, 2, 3 | 4 | s, p, d, f | s, p, d, f | 2 + 6 + 10 + 14 = 32 |
| 5 | 0, 1, 2, 3, 4 | 5 | s, p, d, f, g | s, p, d, f | 2 + 6 + 10 + 14 = 32 |
| 6 | 0, 1, 2, 3, 4, 5 | 6 | s, p, d, f, g, h | y p d | 2 + 6 + 10 = 18 |
| 7 | 0, 1, 2, 3, 4, 5, 6 | 7 | s, p, d, f, g, h, yo | y, p | 2 + 6 = 8 |
* número de electrones por subnivel: s = 2; p = 6; d = 10; f = 14.
De la expresión 2ndos, es posible calcular el número máximo de electrones que puede acomodar cada nivel, aunque esta expresión solo se aplica a los primeros cuatro niveles, en parte debido al desconocimiento de los subniveles posteriores (g, h, i).
número cuántico magnético
El número cuántico magnético (ml) es característico de la cantidad de orbitales para cada subnivel. El valor matemático de m viene dado por m = ± l. Descomponiendo este razonamiento, tendremos: – 1 … 0 … + l. Los orbitales s, p, d, f se muestran a continuación.
- El subnivel s tiene 1 orbital, que es el orbital (0).
- El subnivel p tiene 3 orbitales, que son los orbitales (0), (+1) y (-1).
- El subnivel d tiene 5 orbitales, que son los orbitales (-2), (-1), (0), (+1) y (+2).
- El subnivel f tiene 7 orbitales, que son los orbitales (-3), (-2), (-1), (0), (+1), (+2) y (+3).
número cuántico de espín
El número cuántico de Spin (S oms) caracteriza el posible movimiento de rotación de los electrones, bajo sus ejes imaginarios.
En la imagen de arriba, las flechas indican la dirección de rotación del electrón y este movimiento influye en el llenado de los subniveles, según el Principio de Multiplicidad Máxima (Regla de Hund). De acuerdo con este principio, el llenado de los orbitales debe realizarse de tal manera que se mantenga, siempre que sea posible, el mayor número de electrones desapareados. En la siguiente figura se analizarán dos intentos de llenado.
El emparejamiento solo puede ocurrir cuando no hay más orbitales disponibles para los electrones aislados y, debido al Principio de Exclusión de Pauli, solo dos electrones ocuparán un orbital, siendo la posesión de espines opuestos una condición fundamental para la estabilidad de los electrones.
Ejemplo del elemento hierro (26Fe)
Distribución de plancha electrónica: 1sdos 2 sdos 2p6 3 sdos 3p6 4sdos 3d6
- Teniendo en cuenta que su electrón más energético está en la capa 3, entonces, n = 3.
- Su subnivel es d, entonces l = 2.
- El subnivel d tiene 5 órbitas. Al distribuir los electrones, el último está en el orbital -2, entonces, m = -2.
- Los giros pueden ser + ½ como -½.
¿Qué es la distribución electrónica?
La distribución electrónica es la forma en que se ordenan los elementos químicos según su energía. Es a partir de ahí que los números cuánticos pueden localizar electrones.
Lea también Diagrama de Pauling y Capa de Valencia.