Las principales clases de reacciones estudiadas en la escuela secundaria son precipitación, ácido / base y redox. Este último engloba una serie de reacciones muy versátiles e importantes, como combustión, corrosión, fotosíntesis, extracción de minerales, entre otras. Las reacciones redox también se denominan reducción de oxidación o redox, ya que es una combinación de semirreacciones de oxidación (en la que se pierden electrones) y de reducción (en la que hay ganancia de electrones), por lo tanto, se puede decir que las reacciones de este tipo se ocupan de la migración de electrones de una especie a otra. otro.
Siempre que hay una oxidación, también habrá una reducción, porque, como los electrones son partículas reales, no pueden simplemente «perderse» (ya que en la naturaleza «nada se pierde ni se crea», según Lavoisier), cuando una especie pierde electrones , otra especie los ganará necesariamente, por lo que cada vez que una especie se oxida, otra especie los reducirá.
Por ejemplo, en una de las etapas de formación de óxido, el aire húmedo oxida el hierro sólido (Odos + HdosO), y se puede describir de la siguiente manera:
Semirreacción de oxidación: 2Fe(s) → 2Fe2+(s) + 4e–
Semirreacción de reducción: O2 (g) + 2HdosO(1) + 4e– → 4OH–(aquí)
________________________________________________
Reacción general: 2Fe(s) + O2 (g) + 2HdosO(1) → 2Fe (OH)2 (s)
En este caso, la especie que se está oxidando (perdiendo electrones) es el hierro, mientras que la que se está reduciendo (ganando electrones) es el oxígeno del O.dos. La especie que oxida se llama agente reductor, ya que provoca la reducción de las otras especies. Asimismo, a quien se somete a reducción se le denomina oxidante. Entonces, en este ejemplo dado, el Fe(s) es agente reductor y O2 (g) agente oxidante.
De ahí proviene el término «antioxidante» Los productos antioxidantes son aquellos que tienen sustancias capaces de retrasar o inhibir la oxidación de algún material y, por tanto, pueden ser agentes reductores. Las reacciones de oxidación, aunque son normales (y esenciales) en los organismos vivos, pueden producir radicales libres, potencialmente dañinos para estos organismos. Se cree que muchas enfermedades, como el Alzheimer, el Parkinson, la diabetes, algunos cánceres, entre otros e incluso el envejecimiento de la piel, están vinculados a un «estrés oxidativo» (exceso de oxidación, por así decirlo) y por tanto, medicamentos y antioxidantes. alimentos como uvas, manzanas, brócoli, linaza, etc. se consumen como medio de prevención.
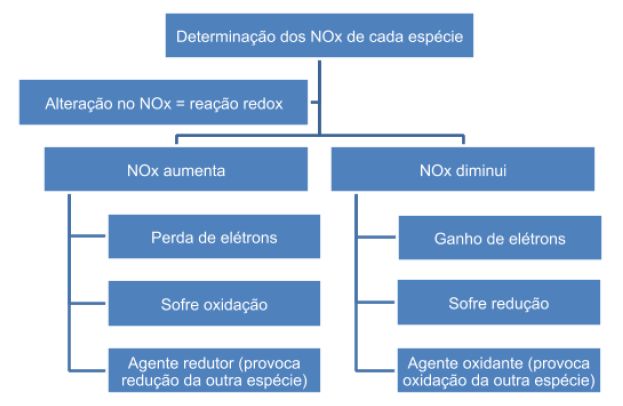
Para comprobar si una reacción es de tipo redox, basta con identificar si existe una variación en el número de oxidación (NOx) de las especies involucradas: si hay una disminución de NOx, significa que la especie se ha reducido, si hay aumento, oxidación y, por tanto, si de oxidación-reducción. La especie que sufrió reducción es el agente oxidante, y la que sufrió oxidación, el agente reductor. A continuación se muestra un diagrama de flujo para resumir esta información:
El fenómeno redox ocurre en reacciones de transferencia de electrones. Acerca de la reacción del permanganato de potasio con peróxido de hidrógeno en un medio ácido, representada por la ecuación desequilibrada a continuación, una especie dona electrones y la otra recibe estos electrones de manera espontánea, lo que se puede verificar variando el número de oxidación.