Según la polaridad, las moléculas se clasifican en polar y no polar.
Cuando una molécula se somete a un campo eléctrico (polos positivo y negativo) y se produce una atracción debido a las cargas, esa molécula se considera polar. Cuando no hay orientación hacia el campo eléctrico, es una molécula apolar.
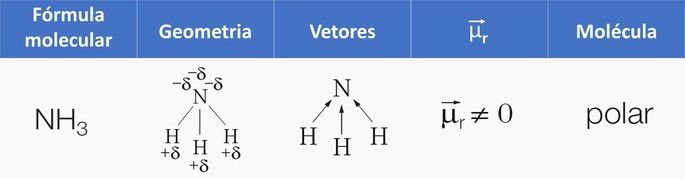
Otra forma de identificar la polaridad es a través de la suma de los vectores de cada enlace polar de la molécula, porque en una molécula no polar, el momento dipolar resultante () es igual a cero. Cuándo
es diferente de cero, la molécula es polar.
En general, dos factores influyen en la polaridad de las moléculas: la electronegatividad de los átomos y la geometría molecular.
Electronegatividad de los átomos
La capacidad de un átomo para atraer electrones compartidos con otro átomo en un enlace covalente se llama electronegatividad.
Vea lo que sucede en la formación de cloruro de hidrógeno:

Según los valores de electronegatividad atribuidos al hidrógeno y al cloro, estos son, respectivamente, 2,20 y 3,16. El cloro tiene mayor electronegatividad y, por tanto, atrae el par de electrones del enlace hacia sí mismo, provocando un desequilibrio de cargas.
La molécula de HCl (ácido clorhídrico) es polar porque forma un polo negativo en el cloro debido a la acumulación de una carga negativa y, en consecuencia, el lado del hidrógeno tiende a tener una carga acumulada positiva, formando un polo positivo.
Lo mismo ocurre con HF (ácido fluorhídrico), HI (ácido yodhídrico) y HBr (ácido bromhídrico), que son moléculas diatómicas, cuyos átomos tienen diferentes electronegatividades.
Moléculas no polares
Cuando una molécula está formada por un solo tipo de elemento químico, no hay diferencia en la electronegatividad, por lo tanto, no se forman polos y la molécula se clasifica como apolar, independientemente de su geometría.
EJEMPLOS:
Una excepción a esta regla es la molécula de ozono, O3.

Aunque está formado solo por átomos de oxígeno, su geometría angular tiene poca polaridad debido a la resonancia entre los pares de electrones libres y apareados en la molécula.
Geometría molecular
Los enlaces covalentes polares se forman por la distribución desigual de electrones entre los átomos de enlace.
Sin embargo, no es solo la presencia de este tipo de enlace lo que hace que una molécula sea polar. Es necesario tener en cuenta la forma en que se organizan los átomos para formar la estructura.
Cuando hay una diferencia de electronegatividad entre átomos, la geometría determina si la molécula es polar o apolar.
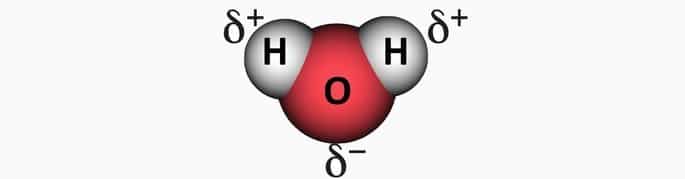
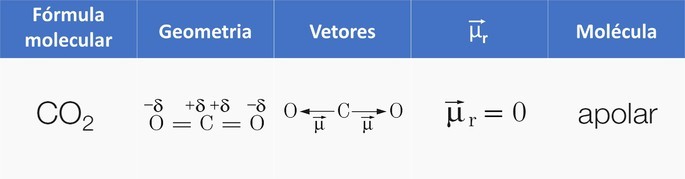
El dióxido de carbono es apolar debido a la geometría lineal que hace que el momento dipolar resultante de la molécula sea igual a cero. Por el contrario, el agua con su geometría angular hace que la molécula sea polar porque el vector de momento dipolar es diferente de cero.
Momento dipolar
Los polos de una molécula se refieren a la carga parcial, representada por , ya que los electrones se comparten y no se transfieren de un átomo a otro.
La polaridad de una molécula con más de dos átomos está determinada por la (vector de momento dipolar resultante), en el que se suman los vectores de cada enlace polar de la molécula. Cuando el resultado es nulo, la molécula es no polar y, en caso contrario, polar.
Ejemplo 1: Molécula de dióxido de carbono, COdos.
| Elemento | Electronegatividad |
|---|---|
| Carbón | 2,55 |
| Oxígeno | 3,44 |
COdos tiene dos enlaces polares, porque el oxígeno es más electronegativo que el carbono.
Como la molécula es lineal, la atracción electrónica de oxígeno «a la izquierda» se ve contrarrestada por la atracción de oxígeno a la «derecha» y, como resultado, tenemos un molécula apolar.

En otras palabras, el momento dipolar resultante es nulo, ya que los vectores tienen:
- misma intensidad (iguales conexiones).
- misma dirección.
- direcciones contrarias.
Ejemplo 2: Molécula de agua, HdosO.
| Elemento | Electronegatividad |
|---|---|
| Hidrógeno | 2,20 |
| Oxígeno | 3,44 |
El agua tiene dos enlaces polares, porque el oxígeno es más electronegativo que el hidrógeno.
En la geometría angular del agua, el lado de los hidrógenos es electropositivo y el oxígeno, electronegativo.

Como los vectores no se cancelan, el vector resultante es diferente de cero, lo que caracteriza a Molécula polar.
Ejercicio con comentarios comentados
1. (Unesp) El efecto invernadero resulta principalmente de la absorción de radiación infrarroja, proveniente de la radiación solar, por moléculas presentes en la atmósfera terrestre. La energía absorbida se almacena en forma de energía vibratoria de las moléculas. Una de las condiciones para que una molécula pueda absorber radiación infrarroja es que sea polar. Basado solo en este criterio, entre las moléculas de Odos, Ndos y HdosO, generalmente presentes en la atmósfera terrestre, contribuyen al efecto invernadero:
haciados, solo.
b) HdosOh, solo.
c) Eldos y Ndos, solo.
d) HdosO y Ndos, solo.
e) Ndos, solo.
Obtenga más conocimiento leyendo los siguientes textos:
dos. (Ufes) La molécula OFdos es polar y la molécula de BeFdos es no polar. Esto es debido a:
a) diferencia de electronegatividad entre los átomos de las moléculas respectivas.
b) geometría molecular.
c) tamaño de los átomos unidos al flúor.
d) alta reactividad del oxígeno en relación con el flúor.
e) el hecho de que el oxígeno y el flúor son gases.
3. (UFSC) Considere la siguiente tabla y seleccione la (s) proposición (es) que relacionan correctamente la geometría y polaridad de las sustancias mencionadas:
| Sustancia | Geometría | Polaridad | |
|---|---|---|---|
| 01 | HdosO | angular | polar |
| 02 | COdos | lineal | apolar |
| 04 | CCl4 | trigonal | polar |
| 08 | NUEVA HAMPSHIRE3 | piramidal | polar |
| dieciséis | CCl4 | tetraédrico | apolar |
Obtenga más información en: