Para la remoción del electrón, el átomo debe estar en estado gaseoso, ya que solo así será posible medir la energía verdadera que será necesaria para la remoción del electrón, y además esta energía es la misma que atrae el núcleo. el electrón, como solo en el estado gaseoso, los átomos están aislados entre sí.
En estas condiciones, le damos el nombre de primera energía de ionización, existe la energía mínima necesaria para la remoción del último electrón de la capa de valencia, pero el primero en ser removido y consecuentemente de menor energía, ya que está más alejado de el núcleo. A medida que se eliminan electrones de las capas, la energía de ionización aumenta, ya que el núcleo tiene más cargas positivas que negativas y es capaz de atraer sus electrones con más fuerza.
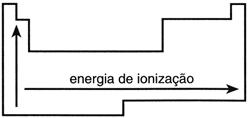
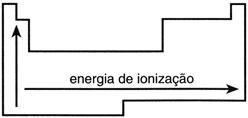
De la tabla periódica de elementos podemos deducir qué elementos tienen la mayor energía de ionización; simplemente siga sus rayos atómicos que cuanto más pequeños, mayor es la energía de ionización, y sus números atómicos que tienen su número de protones, es decir, la carga positiva del átomo, por lo que la energía de ionización crece de izquierda a derecha y de abajo hacia arriba.