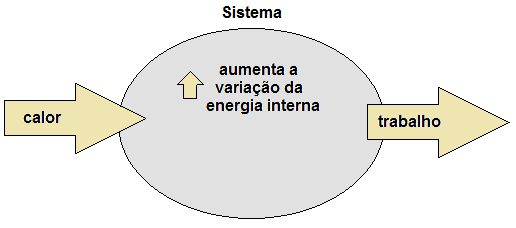
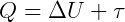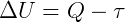Hay dos procesos distintos que pueden variar la energía interna (U) de un cuerpo. Son ellos:
- calor (Q): proceso térmico;
- Trabaja (τ): proceso mecánico.
El calor se debe al contacto entre cuerpos con diferentes temperaturas, con la transferencia de energía térmica, hasta que estas temperaturas se equilibran.
El trabajo implica la aplicación de fuerzas, provocando desplazamientos, como en el caso de la fuerza ejercida sobre un pistón (este se mueve debido a la variación de presión, generada por la fuerza).
El primer principio de la termodinámica busca dilucidar cómo se dan estos dos procesos de intervención en la energía interna del cuerpo, a través del principio de conservación de la energía, que establece que la energía nunca se genera ni se pierde, solo se transforma de una forma a otra.
Julius Robert von Mayer (1814-1878) y James Prescott Joule (1818-1889) comparten el crédito por formular el primera ley de la termodinámica. Ambos llegaron a las mismas conclusiones, por diferentes medios. Concluyeron que
- el calor es una fuente de energía;
- esta energía se conserva.
Considere, por ejemplo, que un sistema recibe 100 julios en forma de calor (Q). Después de eso, realiza un trabajo (τ), usando 60 julios. Los 40 julios restantes permanecen retenidos en el sistema, almacenados en forma de energía interna (ΔU). Así, queda claro que la energía en forma de calor se conservaba, ya que no se perdía, solo se transformaba en trabajo y variación de la energía interna del propio sistema. Así,
- energía en forma de calor (Q): entrar al sistema;
- variación de energía interna (ΔU): permanece en el sistema;
- energía en forma de trabajo (τ): cerrar sesión en el sistema.
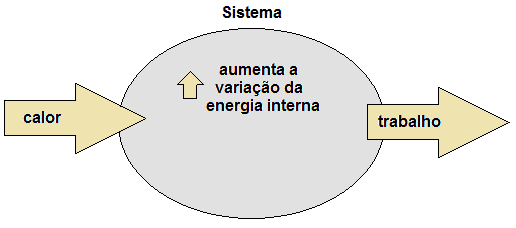
Figura 1. Conservación de energía por el principio de termodinámica.
Por tanto, el calor es equivalente a la suma de las dos formas de energía en las que se transforma:
O bien, la diferencia entre la energía que entra (Q) y la energía que sale (τ) es igual a la variación de la energía interna (ΔU) que permanece en el sistema:
A través de estas ecuaciones, tenemos el enunciado de Primera ley de la termodinámica:
«En un sistema, la variación de su energía interna es la diferencia entre el calor intercambiado con el medio y el trabajo realizado por la fuerza que el sistema ejerce sobre su entorno».
Teniendo en cuenta la primera ecuación, podemos realizar el siguiente estudio de los signos:
| Q> 0 | energía térmica recibida por el sistema |
| Q <0 | energía térmica proporcionada por el sistema |
| τ> 0 | trabajo realizado por el sistema |
| τ <0 | trabajo realizado en el sistema |
| ∆U> 0 | aumento de la temperatura del sistema (calefacción) |
| ∆U <0 | reducción de la temperatura del sistema (refrigeración) |
La Primera Ley de la Termodinámica se estableció especialmente para sistemas gaseosos. Sin embargo, se puede aplicar en cualquier sistema que implique variación de calor, trabajo y energía interna.
Exámenes de ingreso y exámenes
Pregunta 01: (UFRGS 2017)
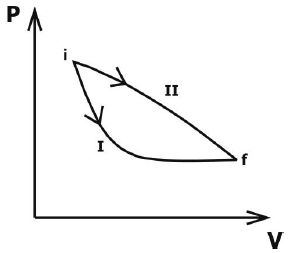
Mire la figura de abajo.
La figura muestra dos procesos, I y II, en un diagrama de presión (P) x volumen (V) a lo largo del cual se puede llevar un gas ideal desde el estado inicial i al estado final f.
Marque la alternativa que llene correctamente los espacios en blanco en la declaración a continuación, en el orden en que aparecen.
Según la 1ª Ley de la Termodinámica, la variación de la energía interna es …….. en ambos procesos. trabajo WI realizado en el proceso I es …….. ese trabajo WII realizado en el proceso II.