Tabla de contenidos
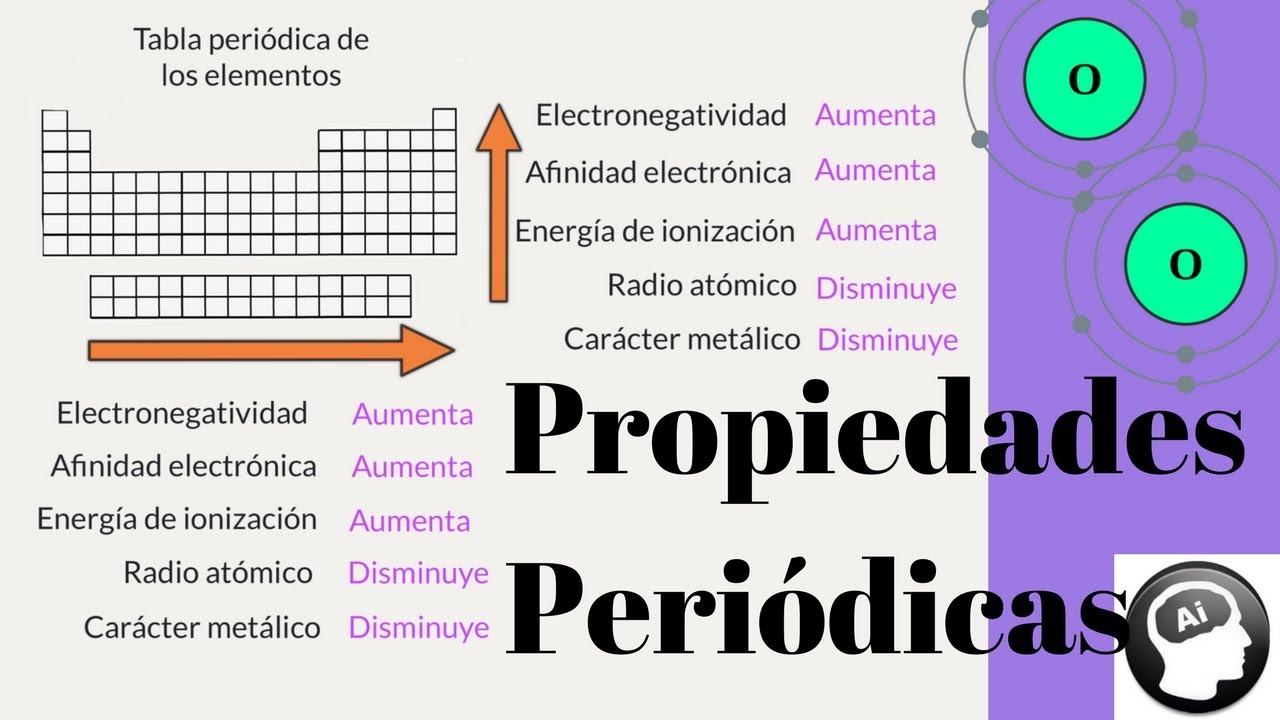
Una de las funciones de la tabla periódica es relacionar las propiedades de los elementos químicos con las estructuras de sus átomos, propiedades que pueden ser de tipo periódico y aperiódico. A propiedades aperiódicas de los elementos son aquellos cuyos valores varían (aumentan o disminuyen) a medida que aumenta el número atómico y que no se repiten en períodos determinados o regulares.
Son propiedades aperiódicas
masa atomica
La masa atómica es la unidad de peso de los átomos que se obtiene comparándola con una cantidad estándar (1/12 de la masa de un átomo de isótopo de carbono 12). Esta propiedad siempre aumenta a medida que aumenta el número atómico, sin hacer referencia a la ubicación del elemento en la tabla periódica.
calor especifico
El calor específico es la cantidad de calor que un gramo de una sustancia necesita absorber para aumentar su temperatura en 1 ° C, sin cambiar su estado físico. El calor específico de un elemento de estado sólido siempre disminuye al aumentar el número atómico.
Tenacidad
La dureza es una propiedad mecánica característica de los materiales sólidos que representa la resistencia de estos materiales al rayado o la penetración cuando se presionan. Esta propiedad depende en gran medida del estado en el que se encuentre el material, así como de las fuerzas de enlace entre sus átomos, moléculas o iones. Cuanto mayor es el número atómico, mayor es la dureza del elemento químico.
Índice de refracción
El índice de refracción es una propiedad física descrita como la relación entre la velocidad de la luz en dos medios diferentes (en el aire y en un cuerpo transparente más denso). Esta propiedad también aumenta con el aumento del número atómico.
Se puede concluir, entonces, que las propiedades aperiódicas de los elementos químicos no se ajustan a la ley de periodicidad de Moseley, que teoriza que muchas propiedades físicas y químicas varían periódicamente en la secuencia de sus números atómicos. Las propiedades periódicas de los elementos químicos, por el contrario, están expresadas por la ley de periodicidad, siendo más comunes y más importantes que las aperiódicas.
Referencias:
http://paraiso.ifto.edu.br/docente/admin/upload/docs_upload/material_2fd0221f7a.pdf
http://pt.scribd.com/doc/54701211/27/Propiedades-Aperiodicas
http://www.dqi.ufms.br/~lp4/ELEMENTOS.PDF